Introduction
항생제 (antibiotics)는 주로 인간과 가축의 질병 예방, 치료의 목적으로 사용되고 그 외에도 가축의 성장 촉진용으로 많이 사용되어진다 (Wang et al., 2015; Chen et al., 2016). 그러나 환경 중에 항생제의 잔류로 인한 항생제 저항 박테리아 생성과 같은 문제가 발생하면서 1980년 말부터 항생제를 신종 오염물질 (emerging contaminants)로 간주하였다.
항생제가 환경 내에 잔류하게 되는 주요 경로는 인간과 가축에 사용된 후 환경에 배출되는 경로, 수산용으로 사용되는 항생제가 수계 내로 유입되는 경로, 그리고 항생제가 생산되는 과정에서 직접 유출되는 경로 등 크게 3가지로 나뉠 수 있다. 환경에 유입된 항생제는 주로 토양에 유입되며 농업용수 또는 강우에 의해 주변 환경으로 이동한다 (Pan and Chu, 2016). 또한 인간과 가축에게 투여되는 항생제는 10 - 20%만이 생체 내에서 활용되고, 80 - 90%가 소변, 대변 등의 분뇨의 형태로 배출된다 (Kim et al., 2017).
농촌 지역 지하수의 주요 오염원은 농경지에 사용된 비료 또는 농약, 그리고 축산폐수 및 가축 분뇨 등이지만 최근 가축 매몰지의 침출수에 의한 병원성 미생물, 항생제 또는 항생제 저항 유전자 (ARG, Antibiotic Resistance Genes)와 같은 신종오염물질의 농촌 지하수 유입 가능성이 높아지고 있다 (Michael et al., 2014).
토양 내 잔류하는 항생제의 잔류 농도는 항생제 자체의 특성, 토양의 물리, 화학적 특성에 따라 매우 다양하다. 특히 항생제의 분자적 구조, 극성 또는 비극성 특성, 그리고 친수성 또는 소수성과 같은 특성에 따라 토양 입자에 흡착이 잘 일어나거나 토양과 흡착하지 않고 토양 컬럼을 통해 지하수로 유입되기도 한다. 테트라사이클라인 계열의 항생제는 수산화 (-OH), 아미노 (-NH2), 그리고 케톤 (-CO)과 같은 작용기가 4개의 벤젠 고리와 결합된 형태이며 토양 유기물을 결합체로 하여 양이온 교환과 같은 메커니즘으로 토양 입자에 흡착 한다 (Li et al., 2016; Ye et al., 2017). 설폰아마이드 계열의 항생제는 4-aminophenylsulfonylamide 형태를 가지고 있어 토양에 흡착되기 보다는 이동이 쉽다 (Kim and Kan, 2016; Riaz et al., 2018).
토양에 유입된 항생제는 작물에 전이되기도 한다. 토양에서 작물에 흡수된 항생제는 작물의 뿌리, 줄기, 잎, 과실 등에 축적되며 작물체에 축적되는 항생제는 항생제의 Kow값에 따라 달라진다. 일반적으로 Kow 값이 큰 소수성 항생제의 경우 체관 (phloem)을 통해 이동하여 과실에 축적되는 반면 Kow 값이 적은 친수성 항생제의 경우 목질부 (xylem)를 통해 이동하여 주로 잎 또는 과실에 축적 된다 (Miller et al., 2016).
본 연구에서는 농촌지역의 농업환경 중 토양과 작물체에 잔류하는 항생제를 모니터링하였으며 선행연구와의 비교를 통해 국내 농업환경에서의 항생제 잔류 특성을 평가하였다.
Materials and Methods
시약 및 재료
항생제는 테트라사이클라인 계열 (Tetracyclines)과 설폰아마이드 계열 (Sulfonamides)의 항생제 중 6종을 사용하였다. 각 항생제 중 SMZ (sulfamethazine)(57-68-1 ≥ 99%), CTC (chlorotetracycline hydrochloride) (64-72-2 ≥ 90%), TC (tetracycline hydrochloride)(67-75-5 ≥ 98%), OTC (oxytetracycline hydrochloride)(2058- 46-0 ≥ 95%)는 Sigma-Aldrich (USA)의 제품을 사용하였고, STZ (sulfathiazole)(72-14-0 ≥ 98%), SMX (sulfamethoxazole)(723-46-6 ≥ 97%)은 FLUKA (USA)의 제품을 사용하였다. 시료 추출용매로 사용된 메탄올 (DAEJUNG, 67-56-1, Korea)과 아세토나이트릴 (DAEJUNG, 75-05-8, Korea)은 HPLC 등급을 사용하였다. 고형상 추출법 (SPE, solid phase extraction)에 사용된 카트리지는 Oasis HLB 카트리지 (Waters, 30 cc, 60 mg, USA)를 사용하였으며, 내부 표준물질로는 Accustandard사의 Simeton (673-04-1, 100 µg mL-1,USA)을 사용하였다.
시료채취 및 전처리
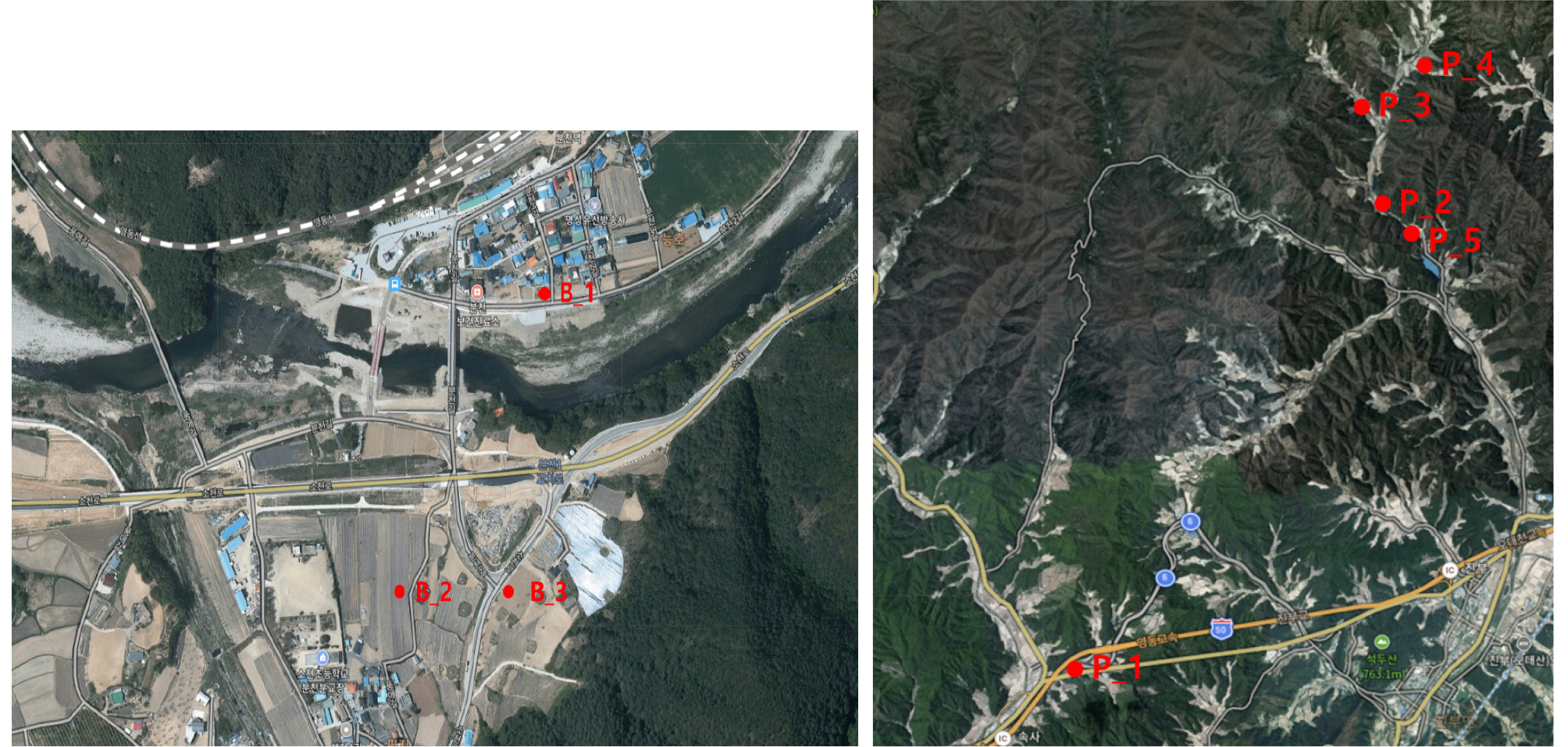
토양과 작물체 내 잔류 항생제를 모니터링 하기 위해 경북 봉화 지역 (3지점)과 강원도 평창 지역 (5지점)의 가축 농장 인근 농경지에서 토양과 작물체를 채취하였다 (Fig. 1). 토양 시료는 표층의 유기물을 제거한 후 휴대용 토양채취기를 이용하여 0 - 15 cm의 토양을 채취하였다. 각 지점별 대표 시료는 시료 채취 지점 100 m2내에서 5군데의 토양을 채취한 후 하나의 시료 채취 용기에 합하여 만들었다.
작물체 시료는 토양 채취 지점과 같은 지점에서 재배되는 작물체를 채취하였으며 채취 작물은 고구마, 무, 수수, 감자, 파, 고추, 당귀 등 다양한 작물체를 채취하였다. 각 작물체는 가식부분만을 채취하였으며 작물체별 2 - 3개의 시료를 채취하였다.
채취된 토양과 작물체는 아이스팩이 담긴 아이스박스에 담은 후 실험실로 운반되었다. 토양 시료는 실온 (18 - 20°C)의 암조건에서 수분함량이 5% 미만이 될 때까지 약 3 - 5일 풍건한 후 2 mm로 체거름하여 4°C에서 냉장 보관하였다.
작물체 시료는 가식 부분을 증류수로 3번 세척한 후 종이 타월을 이용하여 물기를 제거하였다. 각 작물체는 조각으로 세분화한 후 -80°C에서 3일간 냉동 후 동결건조 과정을 거쳐 막자사발을 이용하여 파쇄하였다. 파쇄한 작물체 시료는 믹서기를 이용하여 곱게 파쇄한 후 4°C에서 냉장 보관하였다.
토양의 화학적 특성 분석
토양의 pH와 전기전도도 (EC)는 풍건토양 10 g에 증류수 50 mL을 가하여 1시간 진탕하고 Whatman No.2로 여과한 후 pH meter (MP220, METTLER TOLEDO)와 EC meter (Conductivity Meter S230, METTLER TOLEDO)를 이용하여 측정하였다. 유기물 함량은 Walkley & Black법에 준하여 1N K2Cr2O7을 가하여 반응시킨 후 UV/Vis Spectrophotometer (UV 240 Schimadzu, Japan)로 파장 610 nm에서 비색 정량하였다.
추출, 농축, 및 기기분석
토양과 작물체 내 잔류 항생제 추출 및 농축 방법은 선행 연구 결과를 이용하였다 (Kim et al., 2018). 토양과 작물체 내 항생제를 추출하기 위해 각각 1, 0.1g을 사용하였으며 추출제는 Mcllvaine 완충용액을 사용하였다. 추출된 완충용액을 정제하기 위해 고형상 추출법 (SPE)을 사용하였으며 정제된 시료는 질소 농축기 (N-Evap-11, USA)를 이용하여 50 µL로 농축한 후 이동상 용액 (증류수 99.9% + formic acid 0.1%) 70 µL를 혼합하여 최종 분석 시료는 120 µL를 사용하였다.
항생제 분석에 사용된 기기는 충남대학교 공동실험실습관의 High Performance Liquid Chromatography Tandem Mass Spectrometer (HPLC/MS/MS, 4000 Q trap, ABSCIEX, USA)를 사용하였으며, 이동상의 조성은 A, 99.9% HPLC grade water + 0.1% formic acid (v/v); B, 99.9% acetonitrile + 0.1% formic acid (v/v)를 사용하였다. 사용된 컬럼은 입경 크기 (pore size)가 3.5 µm이며, 내경이 4.6 mm인 Zorbax Eclipse Plus-C18 (Agilent Technologies, USA)을 사용하였다. 항생제 분석을 위한 HPLC/MS/MS 조건은 Tables 1, 2에 나타내었다.
Table 1. parameters of high performance liquid chromatography MS/MS for quantification of veterinary antibiotics in groundwater near at rural area.
Table 2. parameters of high performance liquid chromatography MS/MS for quantification of veterinary antibiotics in groundwater near at rural area.
잔류 항생제 분석의 효율을 극대화하기 위하여 compound optimization을 실시하였다. 항생제 종류별로 1 mg L-1의 표준용액을 조제하여 사용하였으며, 항생제의 분자식을 입력하여 산출된 exact mass값을 대입하였다. 그 후 선구이온 (precursor ion)에 따른 생성이온 (product ion)을 확인하였고, Colloision energy (CE)와 Deculstering Potential (DP)에 변화를 주어 각 항생제의 생성이온의 감도를 증가시켰으며 분석효율이 증대된 최적 조건을 확립하였다 (Table 3).
Table 3. Fragmented ions of nine veterinary antibiotics and internal standard depending on colloision energy and deculstering energy.
QA/QC 및 통계처리
항생제 분석 방법의 QA/QC를 위해 회수율 검정을 실시하였다. 회수율 검정을 위해 대조구 (항생제가 들어있지 않은 순수한 증류수)를 전처리 한 후 항생제를 인위적으로 spiking하는 시점을 각각 SPE 전과 SPE 후로 달리하였다. 회수율 용 시료는 각각의 농도에 SPE 전, 후 spiking하는 시료 2개씩 4개, 바탕시료 1개를 포함한 5개를 준비하였다. 회수율에는 항생제 계열 별로 표준용액을 0.1 mg L-1 과 1 mg L-1로 조제하여 실시하였다. 회수율 검증은 공식 1과 같이 구하였다.
| $$회\mathrm{수율}(\%)=\frac{SPE\mathrm 전\;\mathrm{시료에}\;spiking하\mathrm 여\;\mathrm 검출\mathrm 된\;\mathrm{농도}}{SPE후\;\mathrm{시료에}\;spiking하\mathrm 여\;\mathrm 검출\mathrm 된\;\mathrm{농도}}\times100$$ | (Eq.1) |
검량선을 위한 항생제 standard 용액은 0.01, 0.025, 0.05, 0.1, 0.25, 0.5, 1 mg L-1의 농도로 제조하였다. 모든 분석은 3반복을 실시하였다.
Results and Discussion
토양의 화학적 특성
토양 시료의 화학적 특성은 Table 4에 정리하였다. 토양의 pH는 5.16 - 6.64의 약산성 특성을 나타냈으며 토양의 전기전도도 (EC)는 0.25 - 2.52 mS cm-1의 범위를 나타내었다. 토양 유기물의 함량은 1.29 - 3.99%의 범위를 나타내 채취한 토양 시료의 화학적 특성은 밭토양의 적정범위에 포함되었다.
Table 4. Chemical properties of examined soil.
항생제 분석 QA/QC
토양과 작물체 시료에 대한 항생제 분석의 회수율 및 검출한계 (LOD)에 대한 정보는 Table 5에 정리하였다. 토양과 작물체의 회수율 범위는 각각 72 - 90%, 74 - 90%였으며 검출한계는 0.05 - 0.24, 0.04 - 0.41 µg kg-1 이었다. 토양 및 작물체의 회수율은 모두 적정범위 (70 - 130%) 범위를 만족하였으며 검출한계 역시 환경 내 잔류하는 항생제의 검출에 충분한 검출 한계로 조사되었다.
Table 5. Recovery ratio and limit of quantification of each antibiotics.
토양 내 잔류 항생제 농도
토양 내 잔류 항생제 농도는 Table 6에 정리하였다. 총 6종류의 항생제 중 검출 빈도가 가장 높은 항생제는 SMX, STZ, TC, OTC로 분석한 토양 시료 8지점에서 모두 검출되었으며 검출 농도는 각각 2.36 - 3.02, 2.43 - 3.22, 2.32 - 3.13, 1.05 - 3.34 µg kg-1의 범위로 검출되었다. SMZ의 경우 봉화지역에서는 0.58 - 1.39 µg kg-1의 범위로 모든 지점에서 검출된 반면 평창 지역에서는 오직 P4지점에서 0.12 µg kg-1으로 검출되었다. CTC의 경우 봉화지역과 평창지역 중 각각 1지점에서 검출되었으며 검출 농도는 2.09, 0.58 µg kg-1로 조사되어 검출 빈도가 가장 낮았다.
Table 6. Antibiotic concentration in soil.
토양 내 항생제의 농도는 항생제의 흡착 정도, 토성, 유기물의 함량 등에 따라 다양하게 보고되었다. 중국 양쯔강 유역의 농경지에서 총 25개의 항생제 평균 농도는 41.43 - 105.72 µg kg-1 수준으로 검출되었고 (Zhao et al., 2018a, 2018b), 캐나다 지역에서 분뇨를 농경지에 투입하였을 경우 클로르테트라사이클라인의 농도가 754 µg kg-1 수준으로 검출되었다 (Carlson and Mabury, 2006).
토양에 잔류하는 항생제는 양이온 교환 (cation exchange), 표면 결합 (surface complexation), 그리고 수소결합 (hydrogen bonding)과 같은 메커니즘에 의해 토양 표면에 흡착되며 항생제의 특성 (친수성, 소수성, 이온화, 작용기)에 따라 토양 입자와의 흡착력이 결정 된다 (Zhou et al., 2014). 특히 테트라사이클라인 계열의 항생제는 극성을 띠는 작용기 (-COOH, -C=O, -CONH, -N(CH3)2, -OH)를 포함하고 있어 토양 내 2가 양이온과 강하게 결합하는 특성으로 인해 다른 계열의 항생제에 비해 흡착능이 높아 토양 내 잔류 특성이 높았다 (Gu et al., 2007; Wang and Wang, 2015). 설폰아마이드 계열의 항생제는 분자 구조상 이온화 되기 쉬운 2개의 구조 (염기성의 4-아미노 방향족과 산성 설폰아 작용기)로 되어 있어 일반적으로 토양 흡착력이 낮다 (Pikkemaat et al., 2016).
본 연구에서는 토양 내 테트라사이클라인 계열과 설폰아마이드 계열의 항생제가 고루 검출되었다. 토양 내 잔류 항생제의 농도는 토양 pH와도 상관성이 있다. 테트라사이클라인과 설폰아마이드 항생제의 경우 토양의 pH가 산성 조건 (pH < 7)일 경우 중성 또는 양이온의 특성을 가진 항생제가 토양 표면에 흡착하여 보다 안정적인 잔류 특성을 가진다고 보고하였다 (Schauss et al., 2009). 토양 시료 채취 지점 총 8곳 모두 토양 pH가 7보다 낮은 산성 조건을 가지고 있어 두 종류의 항생제가 안정적으로 흡착되었을 것으로 사료된다.
작물체 내 잔류 항생제 농도
총 6종류의 항생제 중 작물체 내에서 검출 빈도가 가장 높은 항생제는 STZ (100%)와 TC (100%) 였으며 다음으로는 OTC (75%)와 CTC (12.5%) 순으로 검출 빈도가 높았다 (Table 7). 설폰아마이드 계열 항생제 중 SMZ와 SMX는 모든 작물체 내에서 검출되지 않았다. SMX의 경우 모든 토양 시료에서 항생제가 검출된 반면 작물체 내에서는 검출이 되지 않았으며 SMZ 역시 총 8지점 중 4지점의 토양에서 검출된 반면 작물체 내에서는 검출 되지 않았다.
Table 7. Antibiotic concentration in crops.
테트라사이클라인 계열 항생제의 작물 축적 농도 범위는 5.1 - 194.0 µg kg-1이였으며 설폰아마이드 계열 항생제의 작물체 내 농도 범위는 24.9 - 36.3 µg kg-1이었다. 두 계열의 항생제를 비교하였을 경우 검출빈도와 검출 농도 모두 테트라사이클라인 계열 항생제가 설폰아마이드 계열 항생제보다 높았다.
작물체 내 잔류 항생제는 주로 퇴비에 잔류되어 있는 항생제가 토양에 유출된 후 작물체로 전이되는 경로이다 (Pan and Chu, 2017). 선행연구에 의하면 작물체 내 잔류 항생제의 농도는 Kow 변수 값과 상관 관계를 가지며 Kow가 낮은 친수성 항생제의 경우 소수성 항생제에 비해 작물 전이 확률이 높았다 (Wu et. al., 2013). 테트라사이클라인 계열 항생제의 작물 내 축적 농도는 5.6 - 532.0 µg kg-1이며 설폰아마이드 계열 항생제는 2.70 - 4.20 µg kg-1의 작물 내 축적 범위를 나타냈다 (Pan and Chu, 2017). 테트라사이클라인과 설폰아마이드 계열 항생제의 Kow 값을 비교하였을 경우 설폰아마이드의 pH 조정 Kow 값은 -1.5 - 1.0 범위였으며 테트라사이클라인 계열 항생제의 경우 pH조정 Kow 값은 -5.0 ~ -3.0으로 설폰아마이드에 비해 친수성의 특성을 가지고 있어 보다 높은 작물 내 축적 농도를 나타냈다 (Pan and Chu, 2017). 또한 설폰아마이드 계열 항생제는 중성조건에서 음이온으로 존재하며 중성조건 (pH 7.2)을 가진 세포질을 통과하는 과정에서 세포막 또는 세포벽 사이에 흡착되어 작물 전이가 낮게 된다 (Edginaton, 1981).
Conclusion
농촌 환경 내 토양과 작물체 내 항생제 잔류량을 모니터링하였다. 토양과 작물체 모두 Mcllvaine 완충용액을 이용하여 추출하였으며 고형상 추출법으로 정제 후 액체크로마토그래피 탄덤 질량 분석기 (HPLC/MS/MS)를 이용하여 잔류 항생제를 분석하였다. 분석 결과 토양 내 잔류 항생제는 TC와 SA 계열이 각각 0.58 - 3.34, 0.12 - 3.02 µg kg-1 수준으로 검출되었으며 작물체 내 TC와 SA 계열 항생제는 15.1 - 194.0, 24.9 - 36.3 µg kg-1 수준으로 검출되었다. 토양과 작물체에 잔류하는 항생제는 항생제 특성과 토양의 화학적 특성에 따라 잔류 양상이 다름을 알았으며 향후 항생제의 환경 유출 원인인 퇴비 및 액비와 같은 부산물 비료 내 잔류 항생제 모니터링이 필요할 것으로 사료된다.