Introduction
카드뮴오염은 산업화와 도시화로 인하여 급격히 증가하고 있고, 이와 비례적으로 농경지 및 농업용수를 오염시킴으로서 안전농산물 생산에 심각한 악영향을 야기하고 있다. 또한 카드뮴은 토양 내에서 이동성이 높아 저농도의 오염토양에서도 재배하는 작물에 쉽게 흡수‧이행되어 농산물을 오염시킴으로서 먹이사슬의 최정상에 위치한 인간의 생명보전을 위협하는 하나의 요인으로 인식되고 있다 (Galiulin et al., 2001; Hong et al., 2013; Jung et al., 2016; Kim et al., 2008). 카드뮴오염원의 출처는 1차적으로 자연적으로 존재하는 양에 따라 그 분포가 결정되지만, 2차적으로 인간의 사회활동과 산업활동을 통하여 오염범위가 무분별하게 확대되고 있다. 그러므로 카드뮴오염은 인간의 생존권에 막대한 피해를 끼치기 때문에 세계적인 중대한 관심사로 다루어지고 있다 (Jan et al., 2015; Kirkham, 2006; Nagajyoti et al., 2010).
카드뮴은 생체 내에서 대사작용에 중요한 기능을 담당하는 효소 또는 단백질의 황화수소기 (sulfhydryl group, -SH)의 친화력을 약화 또는 교란시킴으로서 식물뿐만 아니라 인축에도 치명적인 생체기능장애를 야기하고 있다 (Jung et al., 2015; Jung et al., 2016; Mengel and Kirkby, 1978; Meuwly and Rauser, 1992). 카드뮴독성은 식물체 내에 과잉의 활성산소종 (reactive oxygen species, ROS)을 유발‧축적하여 생명유지의 기본물질인 탄수화물, 단백질, 지방 및 핵산의 생합성을 감소시키고 광합성, 호흡, 이온흡수 및 산화·환원 (redox) 항상성 유지 등에도 악영향을 끼치므로 정상적인 생체기능을 크게 저해한다 (Gayomba et al., 2013; Jung et al., 2015; Jung et al., 2016; Petrov et al., 2015; Singh and Agrawal, 2010). 식물체 내로의 카드뮴 흡수‧축적량은 토양 내에 존재하는 카드뮴함량에 비례적으로 증가되고, 흡수‧이행된 카드뮴에 의해 유발되는 식물독성을 최소화하기 위하여 다양한 생리·생화학적 무독화 기전을 가동하여 독성을 극복한다 (Jeoung et al., 2013; Kim et al., 2008; Raven and Loeppert, 1997; Salt et al., 1995).
식물체 내로의 카드뮴흡수, 전이 및 축적은 식물종 및 토양 내의 pH, 유기물, 산화‧환원, 토양유형 등 토양환경조건에 따라 달라진다는 많은 연구사례들이 보고되었다 (Hong et al., 2013; Kim et al., 2008; Lee et al., 2018; Park et al., 2009; Yan et al., 2010a; Yan et al., 2010b). 그렇지만 카드뮴오염도에 따른 수치화된 생육저해수준과 토양으로부터 식물체의 각 조직부위로의 카드뮴전이율 및 축적양은 잘 정형화되어 있지 않았을 뿐만 아니라 카드뮴농도와 생물농축계수 (bioconcentration transfer, BCF) 간의 연관성을 비교한 연구도 미흡한 상태이다. 그러므로 카드뮴오염도에 따른 유채의 생육저해율 산출과 식물부위별 생물농축계수의 비교‧분석은 카드뮴의 식물축적량 예측을 가능하게 할 것이고, 카드뮴오염 농경지의 안전농산물 생산관리 및 제공에 기여할 것으로 판단된다. 따라서 본 연구는 1) 카드뮴농도에 따른 수치화된 유채의 생육저해수준 산출과 2) 토양 내의 카드뮴농도와 인산 및 칼륨 간의 상관성을 파악하고 3) 카드뮴농도에 따라 토양으로부터 식물체 각 부위별로의 카드뮴 생물농축계수 및 축적량 간의 연관성을 평가하고자 수행하였다.
Materials and Methods
토양시료 및 시험식물
본 연구에 이용된 토양은 국립농업과학원 내 시험포장에서 채취하여 처리구별 토양을 조제한 후 사용하였다. 인위적인 고농도의 카드뮴 오염토양은 식양토를 채취하여 풍건세토 후 2 mm 체로 걸러진 토양에 충분한 양의 물로 용해시킨 염화카드뮴 (CdCl2; Sigma-Aldrich, Inc.)을 첨가하여 조제하였고, 이 오염토양은 2년 이상의 안정화과정을 거친 후 인위적 카드뮴 오염토양으로 이용하였다. 카드뮴의 토양혼화처리는 550 mg kg-1 농도의 인위적 카드뮴 오염토양을 식양토에 희석하여 4수준의 카드뮴처리구 (0, 4, 8, 12 mg kg-1)를 조제하였고, 질소, 인산 그리고 칼리질비료는 국립농업과학원 작물별 시비처방기준에 의거하여 각기 100, 80, 그리고 80 kg ha-1으로 토양에 혼화처리하였다. 시험식물인 탐미유채를 온실조건 하에서 원예용 상토로 충진된 규격육묘상 (5 × 10 tray)에 파종하고 균일하게 생장한 5엽기의 유묘를 선별하여 각 처리구별 Wagner 포트 (0.02 m2 표면적, 평균용적밀도 1.2 g cm-3, 3.5 kg 처리토양 충진)에 1주씩을 이식하고, 자연광에서 주야간 30/20°C 평균온도를 유지하였다. 또한 양호한 토양수분조건 (포장용수량 수준)을 유지하기 위하여 무처리의 유채생육과 토양수분상태에 따라 2∼3일을 주기로 모든 처리포트에 동일한 양의 수돗물을 공급하면서 이식기 (3월 2일)부터 개화기 (4월 20일)까지 49일 동안 실험을 수행하였다.
토양화학성 및 카드뮴 전함량 분석
토양화학성은 국립농업과학원 토양화학분석법에 준하여 실시하였다 (NIAS, 2010). 토양화학성과 카드뮴의 전함량 분석을 위하여, 음지에서 풍건한 각 처리별 약 200 g 토양시료를 고무망치로 잘게 부수어 2 mm 표준체로 거른 시료들은 토양화학성 분석에 사용되었다. 토양 카드뮴 전함량 분석을 위해 1차 걸러진 토양시료를 다시 막자사발로 곱게 마쇄한 후 0.15 mm 체를 통과한 시료가 최종적으로 카드뮴분석에 이용되었다. 토양 카드뮴분석은 시료를 왕수 (conc. HCl + HNO3)로 150°C에서 2시간 분해한 다음, 유도결합프라즈마 원자방출분광기 (ICP-AES, AU/CINTRA 6, GBC Scientific, Australia)로 측정하였다 (Jung et al., 2017b). 본 시험에 사용한 카드뮴처리구 토양의 화학성과 카드뮴함량은 Table 1에 나타내었다.
식물생장반응 및 분석
카드뮴독성에 대한 생장반응을 분석하기 위하여, 개화기에 지상부 생체중 및 건물중, 뿌리 건물중, 그리고 지상부 수분함량을 조사하였다.
식물체 내 양이온과 카드뮴함량 분석
식물체분석은 국립농업과학원 토양 및 식물체분석법에 의거하여 실시하였다 (NIAS, 2000). 개화기에 채취한 식물체 시료는 뿌리와 지상부로 나누고, 각기 시료들을 수돗물로 부착된 먼지 또는 미세토양입자를 완전히 제거한 후 다시 증류수로 수회 세척하였다. 이 세척된 시료들은 80°C에서 완전히 건조시킨 후 분쇄하여 분석에 이용하였다. 식물체의 양이온 (K, Fe)과 카드뮴함량 분석을 위하여, 시료분해는 Graphite Block Acid Digestion System (ODLAB Co., Ltd. Seoul, Korea)을 이용하였고, 건조된 분말시료 200 mg에 14 mL 질산을 넣고 산분해한 분해액을 여과지 (No. 40, Whatman, Buckinghamshire, UK)에서 불순물을 제거한 후, 유도결합플라즈마 질량분석기 (ICP-MS, Agilent 7900, Agilent Technologies Inc., Santa Clara, CA, USA)에서 양이온 및 카드뮴함량을 측정하였다 (Jung et al., 2017b).
데이터 분석과 통계처리
카드뮴농도와 유효인산 (available P2O5) 및 치환성칼륨 (exchangeable K) 간의 상호연관성 분석은 선형회귀분석으로 평가되었다.
카드뮴 처리농도에 따른 생장저해를 평가하기 위하여, 무처리에 대한 평균생장량을 백분율로 표준화하여 나타냈다. 식물생장저해는 선형회귀를 이용하여 분석되었고, 25% 지상부 건물중 (GR75)을 감소시키는 토양 중 카드뮴함량은 회귀방정식을 통하여 산출하였다.
지하부 (뿌리)와 지상부 간의 카드뮴 전이관계는 4 수준의 카드뮴처리에서 얻어진 뿌리와 지상부 카드뮴함량을 사용하여 선형회귀로 분석하였다.
토양에서 뿌리 또는 지상부로의 카드뮴 생물농축계수 (bioconcentration factor, BCF)는 아래의 수식으로 계산되었다.
BCF = Ca/Cb 이고, Ca는 뿌리 또는 지상부의 카드뮴농도이며 Cb는 토양의 카드뮴농도를 나타낸다.
본 연구는 완전임의배치 3반복으로 온실에서 수행하였고, 모든 데이터의 통계처리는 Statistical Analysis Software (SAS ver. 9.2) 프로그램을 사용하여 처리 간 분산분석 (ANOVA)을 실시하였다. 처리의 효과는 Fisher 최소유의차 검정 (p=0.05)을 통하여 유의성 유무를 판단하였고, 데이터는 평균값 ± 표준편차로 표현하였다.
Results and Discussion
카드뮴 수준별 토양화학성 변화
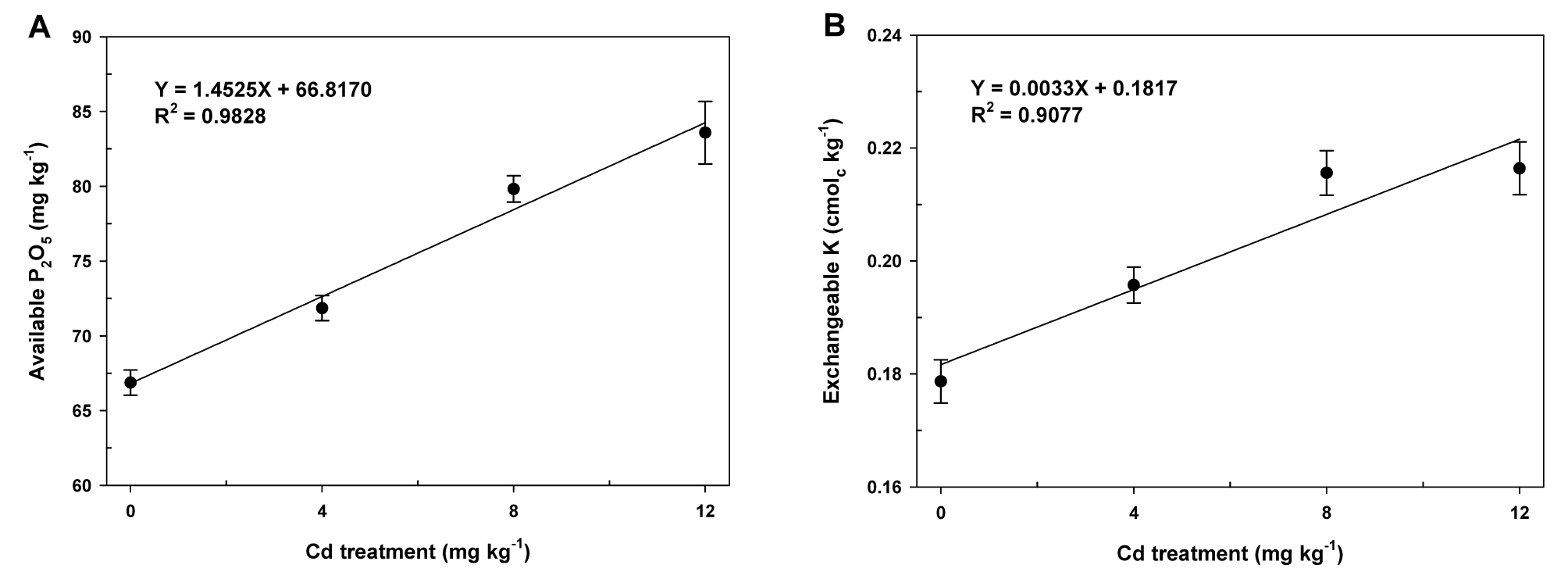
카드뮴을 0, 4, 8, 또는 12 mg Cd kg-1로 처리된 토양의 화학적 특성은 이식전 (시험전)과 개화기 (시험후)에 토양시료를 채취하여 분석하였다. 이들 시료로부터 분석된 토양화학성 중에서 유효인산과 치환성칼륨을 제외하고, 시험전과 시험후에는 화학적 특성에 변화를 확인할 수 없었다. 비록 시험전의 유효인산과 치환성칼륨은 처리 간에 통계적인 차이가 없었음에도 불구하고, 시험후에는 이들 모두에서 유의적인 차이를 나타냈다 (Table 1). 토양 중 카드뮴농도가 증가함에 따라 비례적으로 유효인산과 치환성칼륨의 잔존량 증가가 관찰되었고, 카드뮴농도와 유효인산 (Fig. 1A) 및 치환성칼륨 (Fig. 1B) 간에 정의 상관관계를 확인하였다. 이 결과와 매우 유사하게 Arshed et al. (2016)은 수경재배조건에서 밀 (Triticum aestivum L.)의 지상부와 뿌리 모두에서 카드뮴처리에 따른 칼륨과 인산농도의 유의적인 감소를 보고했다. 또한 Jalil et al. (1994)은 카드뮴이 칼륨의 식물흡수를 경쟁적으로 저해한다고 보고하였다. 인산은 토양입자의 카드뮴 흡‧탈착에 영향을 미칠 수 있고, 카드뮴의 용해도 및 생체이용률을 저하시킬 수 있기 때문에 카드뮴은 식물체 내로의 인산흡수를 방해하는 요인 중의 하나가 될 수 있다 (Cui et al., 2017; Hong et al., 2013; Kim et al., 2008; Lee and Hong, 2016; Lee et al., 2018; Yin et al., 2016). 이상의 결과는 인산과 칼리질비료가 비교적 낮은 카드뮴오염도를 나타내는 농경지에서 경작시 작물생육에 중요한 제한요소로 작용할 수 있을 것이다.
카드뮴 수준별 카드뮴함량 및 생장저해양상 변화
카드뮴은 금속이온을 함유한 단백질의 이온을 치환함으로서, 이 단백질들의 기능장애를 일으키고 활성산소종을 유발시켜 세포 내에서 지질과산화를 야기한다. 이로 인한 세포막 파괴는 엽록소함량을 감소시키고 광합성효율을 약화시킴으로서 전반적인 생육저해에 따른 생물체량 감소를 초래하고, 결국에는 식물체를 고사하게 한다 (Gayomba et al., 2013; Jung et al., 2015; Jung et al., 2016; Jung et al., 2017a; Petrov et al., 2015).
카드뮴 수준별 시험전‧후 카드뮴 잔존량 변화는 고농도로 처리된 8 및 12 mg kg-1에서 9∼10% 감소를 나타냈지만, 저농도로 처리된 4 mg kg-1에서는 유의적인 차이가 없었다 (Fig. 2A).
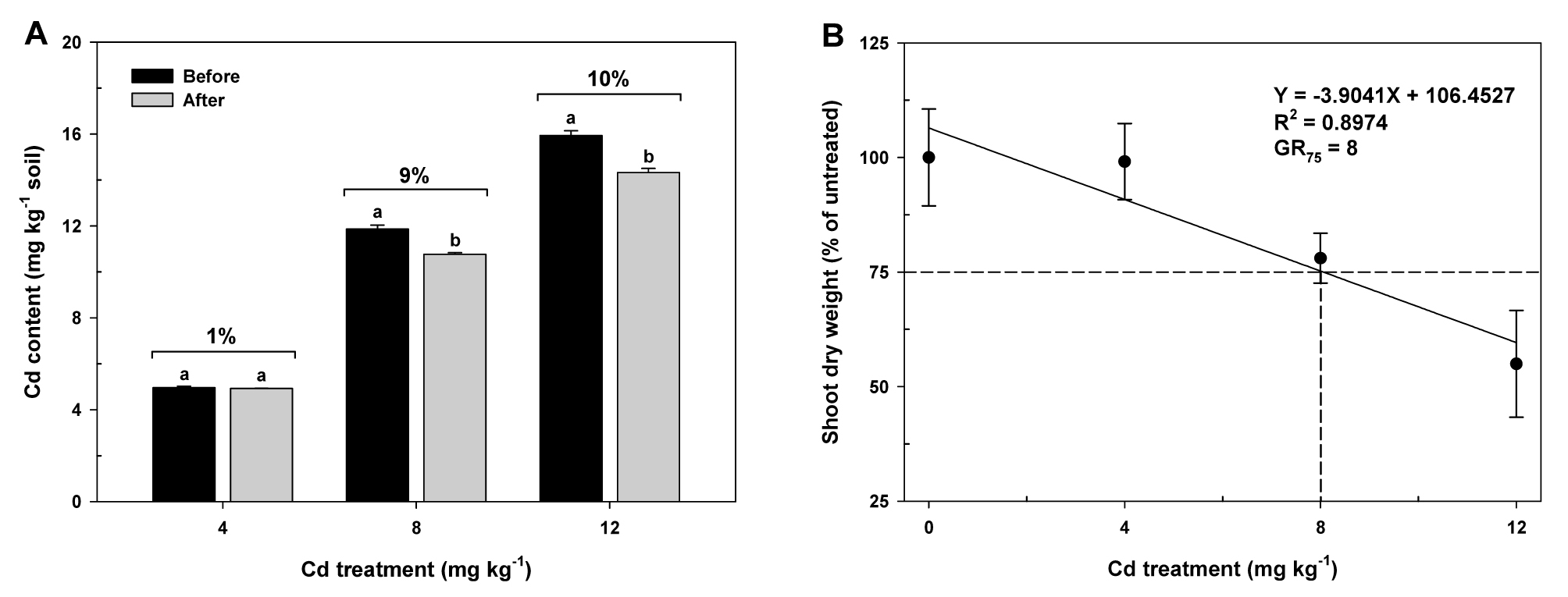
Fig. 2.
Changes in Cd content of the soil before transplanting oilseed rape seedlings (Before) and after harvesting oilseed rape plants at flowering stage (After), and the reduction rates (figures at top of the columns) of Cd content (A), and effect of Cd treatments on shoot dry weight of oilseed rape plants at flowering stage (B). GR75 value is the Cd concentration that reduced shoot dry weight by 25%. Each data point is the mean ± standard deviations of three replications. Means denoted by the same letter are not significantly different at the 5% level, according to Fisher’s least significant difference (LSD) test.
유채 개화기의 생육조사에서 카드뮴농도의 증가에 따라 지상부 수분함량을 제외한 지상부 생체중 및 건물중, 그리고 뿌리 건물중에서 점진적인 감소를 확인하였다 (Table 2). 본 연구결과에서 카드뮴농도에 의존적인 생체량 감소를 관찰할 수 있었고, 카드뮴 수준증가에 따른 정량적인 생장저해를 산출하기 위하여, 카드뮴농도에 비례적으로 생장저해를 나타낸 지상부 건물중을 매개변수로 이용한 회귀분석을 실시하였다. 유채생장은 카드뮴농도가 증가함에 따라 직선적으로 감소하였고, 카드뮴에 의한 식물독성으로 25% 생장저해 (GR75)를 나타내는 카드뮴농도가 대략 8 mg kg-1 수준이라는 것을 도출하였다 (Fig. 2B).
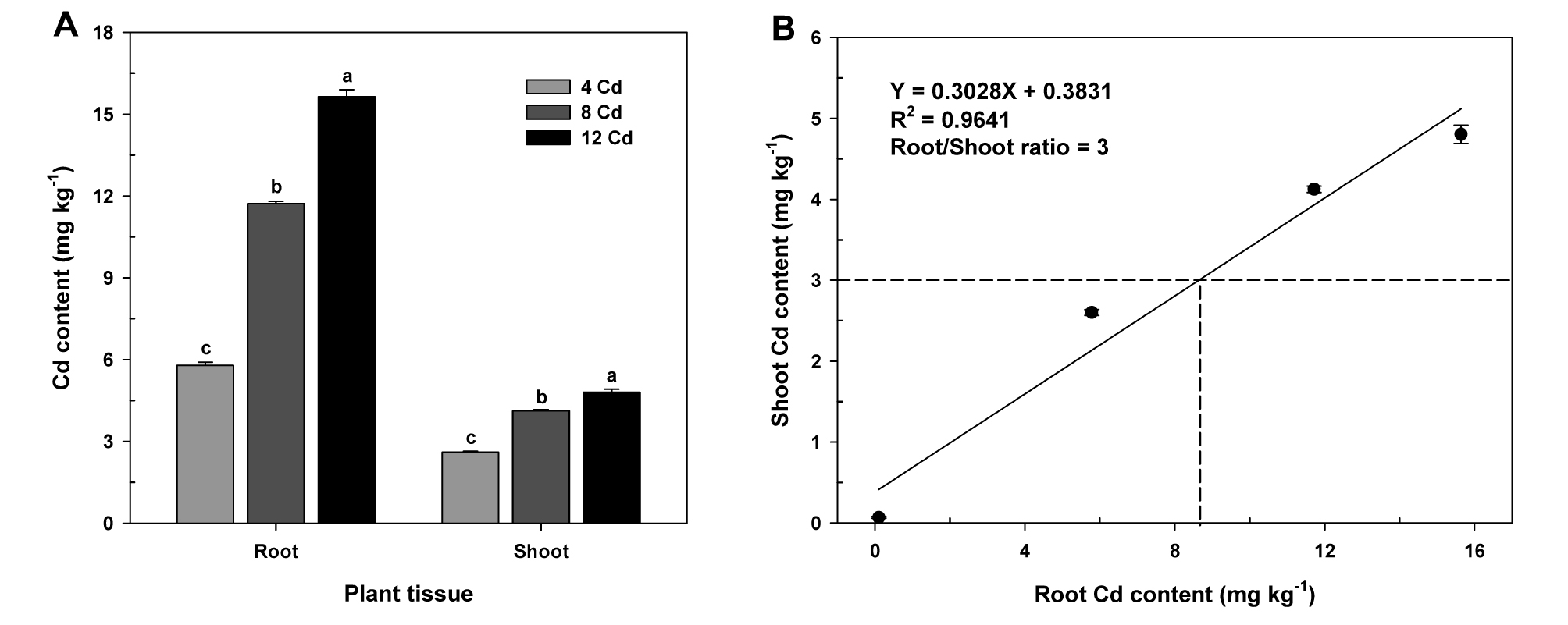
Fig. 3.
Effect of Cd treatments on Cd content in the roots and shoots (A) and relationship between root- and shoot-Cd content of oilseed rape plants at flowering stage (B). Each data point is the mean ± standard deviations of three replications. Means denoted by the same letter are not significantly different at the 5% level, according to Fisher’s least significant difference (LSD) test.
식물체 부위별 카드뮴 및 양이온함량 변화
유채 개화기에 조사된 뿌리와 지상부의 카드뮴함량은 처리수준에 비례하여 증가하였고, 식물체의 카드뮴함량은 지상부보다 뿌리에서 더 높게 나타났다 (Fig. 3A). 뿌리와 지상부의 카드뮴함량 간에는 정의 상관관계를 보였고, 카드뮴의 root/shoot 비율은 3으로 나타났다 (Fig. 3B). 이는 토양으로부터 뿌리로 흡수‧축적된 카드뮴의 30% 이상이 지상부로 전이되는 것으로 다른 중금속에 비해 상대적으로 많은 양이 이행됨을 보여주는 결과이다 (Jung et al., 2017b). 따라서 카드뮴은 다른 중금속에 비해 토양에서 뿌리 그리고 지상부로의 고이행성을 지니기 때문에 저농도의 토양오염수준에서도 오염토양관리가 필요하다는 것을 시사한다 (Hong et al., 2013).
식물체 내에서 칼륨은 기공개폐, 광합성 및 항산화제 생합성 등에 필수적으로 요구되는 양분이고 (Wang et al., 2013), 철은 활성산소종 소거에 관여하는 항산화효소의 보조인자로 쓰일 뿐만 아니라 산화‧환원조절 등의 중요한 역할을 담당하는 필수금속이온이다 (Gayomba et al., 2013). 이 양분들의 항상성이 교란된다면 식물체는 급격한 광합성 감소, 산화‧환원의 항상성 불균형과 더불어 활성산소종 소거에 지장을 초래할 것이므로, 이 양분들의 식물부위별 변화는 생체 내의 생리·생화학적 대사작용과 식물독성경감 연구에 중요한 정보를 제공할 것이다 (Jung et al., 2015; Jung et al., 2016; Jung et al., 2017a; Siddiqui et al., 2012). 이러한 취지에 따라 카드뮴 처리수준별 칼륨과 철의 항상성 변화를 분석하였다. 식물체 내 칼륨함량은 뿌리보다 지상부에 2배 이상 많이 존재했던 반면 철은 오히려 지상부보다 뿌리에 다량이 잔존하고 있었다 (Fig. 4A, B). 카드뮴 처리수준의 증가에 따라 식물체 내의 칼륨함량은 뿌리와 지상부 모두에서 일정한 경향성을 나타내며 감소하였다 (Fig. 4A). 위 칼륨의 결과와 비슷한 경향으로 지상부의 철함량 또한 카드뮴농도의 증가에 따라 순차적인 감소를 나타냈지만, 뿌리는 특정한 경향성을 보이지 않고 4와 8 mg kg-1 카드뮴 처리에서 유의적으로 높게 나타났다 (Fig. 4B). 이상의 결과는 카드뮴 처리수준별 토양 내에 잔존하는 치환성 칼륨함량 (Fig. 1B)과 매우 높은 경향성을 나타내고 있을 뿐만 아니라 식물체 내의 칼륨과 철 항상성 교란은 카드뮴농도에 의존적으로 가중됨을 확인할 수 있었다 (Fig. 4A). 이는 원천적으로 카드뮴과 화학적 특성이 비슷한 원자가에 기인한 길항작용의 결과로 생각되고, 더불어 그 원소들의 흡수를 담당하는 이온운반체들의 활성을 경쟁적으로 저해함으로서 항상성 변화에 영향을 미치는 것으로 판단된다 (Wang et al., 2014; Yin et al., 2016).
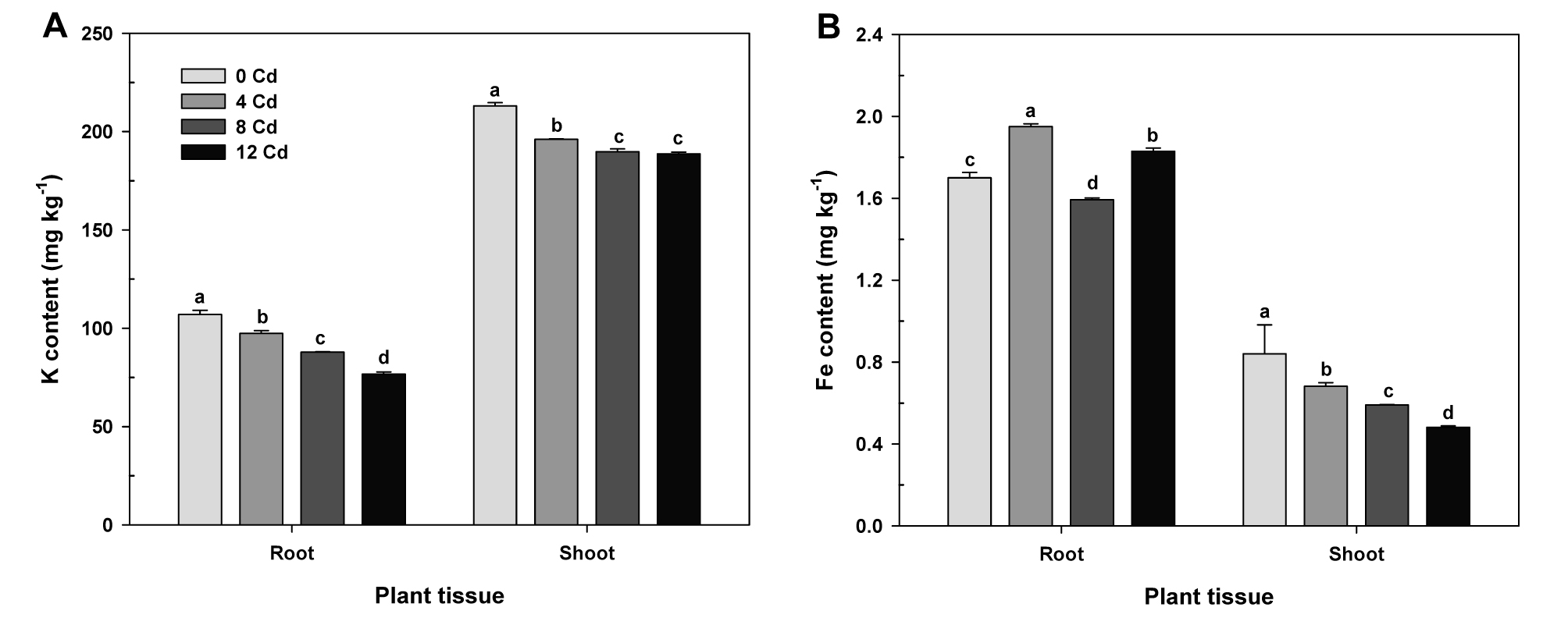
Fig. 4.
Effect of Cd treatments on the K (A) and Fe (B) content in roots and shoots of oilseed rape plants at flowering stage. Each data point is the mean ± standard deviations of three replications. Means denoted by the same letter are not significantly different at the 5% level, according to Fisher’s least significant difference (LSD) test.
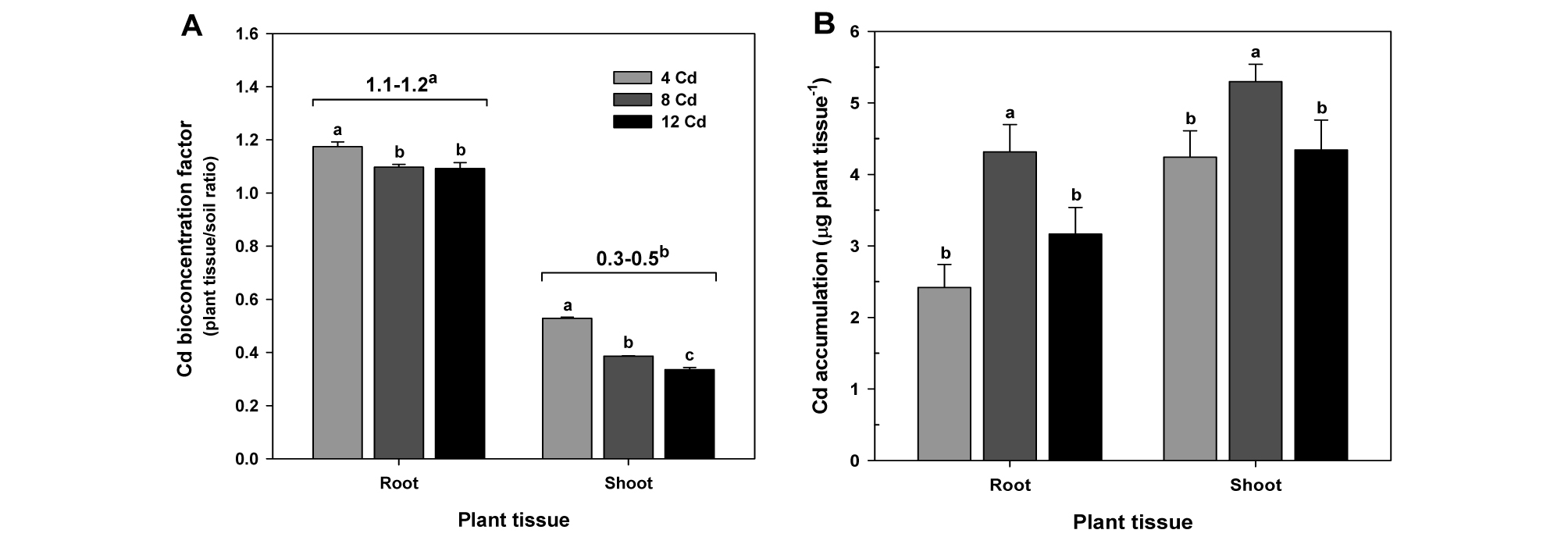
카드뮴 수준별 카드뮴 전이계수 및 축적
카드뮴 처리수준이 증가함에 따라 토양-식물체의 생물농축계수 (BCFplant tissue/soil)는 뿌리와 지상부 모두에서 유의적으로 감소를 나타냈다 (Fig. 5A). 토양-뿌리의 생물농축계수 (BCFroot/soil)는 1.1∼1.2 값을 나타냈지만, 토양-지상부의 생물농축계수 (BCFshoot/soil)는 0.3∼0.5 값을 보였다. 카드뮴의 식물체 축적평가는 생물체량을 기반으로 하였기 때문에 카드뮴 축적량은 3 수준의 카드뮴처리에서 저농도 (4 mg kg-1)와 고농도 (12 mg kg-1)보다 중간농도 (8 mg kg-1)에서 가장 높은 축적량을 나타냈다 (Fig. 5B). 이상의 결과는 카드뮴 축적이 토양 내 카드뮴 오염수준보다 오히려 생물체량에 크게 의존하고 있기 때문이라 판단된다. 따라서 유채의 카드뮴 축적은 식물생육저해가 최소화된 허용오염농도에서 더 효율적으로 카드뮴을 축적할 수 있다는 결론을 내릴 수 있다.
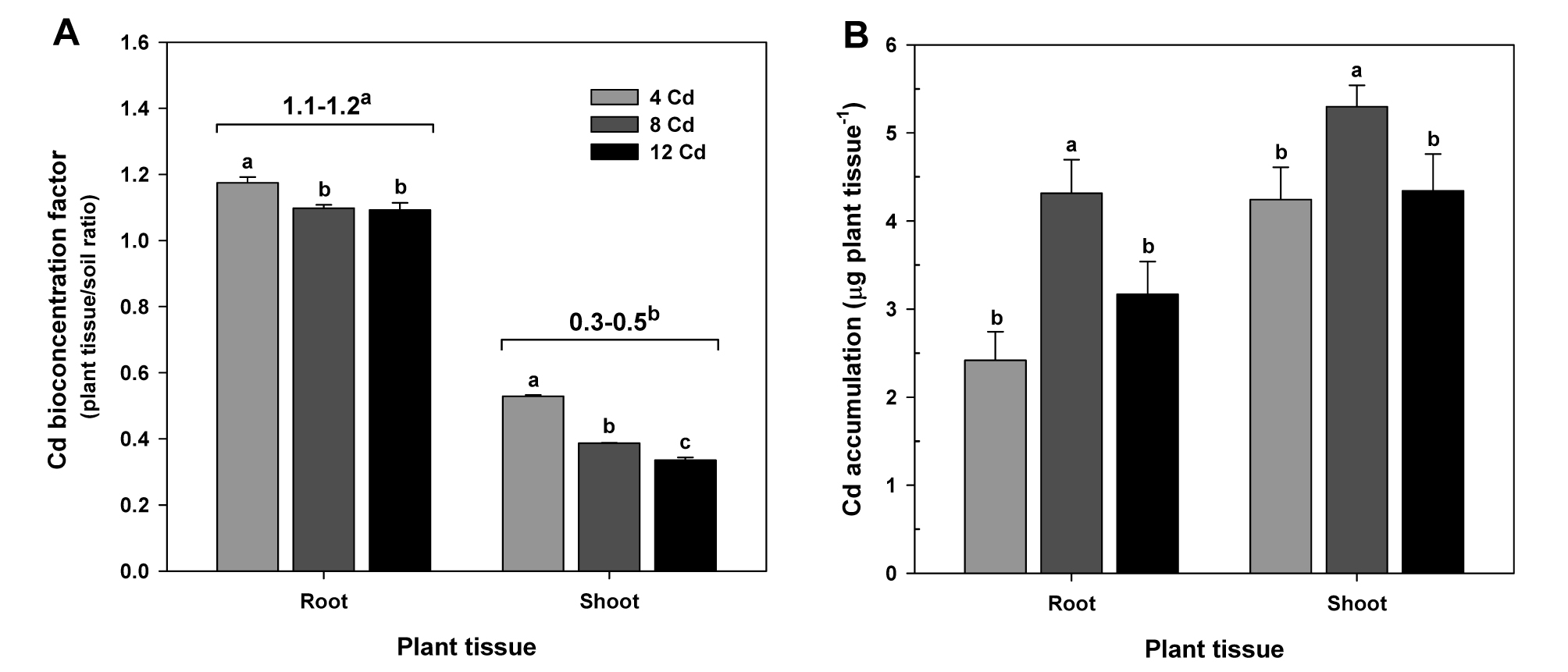
Fig. 5.
Effect of Cd treatments on Cd bioconcentration factors between soil and root or shoot (A) and Cd accumulations in roots and shoots of oilseed rape plants at flowering stage (B), and comparison of the bioconcentration factors between root and shoot tissues (figures at top of the columns). Each data point is the mean ± standard deviations of three replications. Means denoted by the same letter are not significantly different at the 5% level, according to Fisher’s least significant difference (LSD) test.
Conclusion
유채의 생육은 카드뮴 농도에 따라 직선적으로 감소되었고, 이러한 총체적인 생장저해는 식물생육에 필수적인 양분인 인산, 칼륨 및 철의 흡수를 억제하였다. 그러므로 카드뮴오염지에서 인산, 칼륨 그리고 철의 시비관리를 통하여 카드뮴에 의해 야기되는 식물독성을 완화시킬 수 있는 하나의 방안이 될 수 있을 것으로 생각된다. 토양에서 식물체 내로의 카드뮴전이는 처리농도의 증가에 따라 감소하였고, 카드뮴축적은 식물생육과 밀접한 연관성을 지니고 있어 식물생장이 가능한 농도범위에서 최고치의 축적량을 나타냈다. 따라서 카드뮴농도가 식물생장에 반해 임계농도를 초과하면 오히려 생육감소에 따른 축적량이 동반하여 감소됨으로 식물을 이용한 카드뮴오염토양의 정화시, 식물종별 생육한계농도 결정이 우선되어야 할 것이다. 또한, 카드뮴은 식물체 내로의 이행성과 축적효율이 매우 높기 때문에 저농도의 카드뮴오염 농경지에서도 안전한 농산물 생산을 위한 관리대책이 필요할 것으로 판단된다.