Introduction
Materials and Methods
Results and Discussion
Conclusion
Introduction
친환경 안전한 먹을거리에 대한 소비자 선호도 증가와 더불어 건강에 도움이 되는 농산물의 관심이 증대되고 있다. 고구마 (Ipomoea batatas L.)는 메꽃과에 속하는 쌍떡잎 식용작물로 식이섬유가 많이 함유되어 있어 웰빙식품으로 알려져 있다 (Kim et al., 1995; Jung et al., 1998; Park et al., 2006). 일반적으로 단위면적당 수확량이 많고 환경적응성이 강하여 미래식량 자원으로 기대되고 있으나 (Shin et al., 2011) 고구마 재배과정에서 Fusarium oxysporum에 의한 덩굴쪼김병이 발생되어 농민들은 심각한 피해를 받고 있다. 고구마 덩굴쪼김병은 Fusarium oxysporum f. sp. batatas가 뿌리나 줄기의 상처를 통해 감염되는 토양병해로 연작이 심할수록 발병률이 높다 (Harter and Field, 1914; McClure, 1949). 덩굴쪼김병의 발병적온은 28-30°C이며 (Clark and Moyer, 1988) 토양 수분이 적을수록 많이 발생되는 것으로 알려져 있다 (Harter and Whitney, 1927). 발병은 사질 계통의 유기물 함량과 수분 함량이 낮은 척박한 연작지 토양에서 가뭄과 지온이 높아질 때 발생이 심하다. 특히 토심이 50 cm 이하이고 경사가 7% 이상으로 토양수분과 양분의 유실이 큰 조건에서 발병이 높다 (Jung et al., 2001). 그리고 감염된 씨고구마, 묘, 작업도구나 동물 등에 붙은 흙 등을 통해서 전염되며 삽식 이후 발근 시기에 침입하여 초기 생육을 저해하며 생육 후기까지 영향을 미친다. 국내에서는 덩굴쪼김병에 대하여 Park (1967)이 최초로 보고하였으며 1990년대 중반에 고구마 주요 생산단지인 해남에서 발병되어 농가소득에 큰 손실을 가져왔다 (Lee et al., 2004). 이러한 문제를 해결하기 위한 방법으로는 무병 씨고구마 활용 건전묘 생산, 살균제 침지, 발근제 처리, 적지재배, 유기물 시용, 윤작, 이병주 제거 등이 알려져 있다 (Jung et al., 2001; Yoo and Lee, 2013). 또한, 덩굴쪼김병의 방제를 위해 비병원성 Fusarium sp. 균의 접종으로 생태적인 효과를 검토한 결과도 있다 (Ogawa,1988; Fravel et al., 2003). 그러나 현재까지도 고구마 덩굴쪼김병의 예방과 방제효과에 대한 연구는 미흡한 실정이며 농가소득 안정을 위해서는 효과적인 방제법 개발이 필요하다. 대부분의 병원균은 주로 상처난 부위의 세포나 조직으로 침투하여 병을 유발하기 때문에 상처부위를 미리 치료하는 큐어링 방법도 활용할 수가 있다 (Aidoo, 1993; Booth, 1974; Van Oirschot et al., 2006). 묘는 정식전 5~10일간 온도 16°C, 상대습도 85%의 약광 조건하에서 큐어링 처리를 할 경우 뿌리의 신장이 촉진되어 묘의 활착 및 괴근 분화가 촉진된다고 알려져 있다 (Nakatanni, 1987; Jeong, 1996).
따라서 본 연구는 고구마 묘 삽식을 위한 전처리 방법으로 큐어링 처리 기간이 덩굴쪼김병과 수량에 미치는 영향을 검토하여 농가에 활용코자 수행하였다.
Materials and Methods
재배 및 토양 조건
본 시험에 사용한 고구마 품종은 일본도입종인 安納紅 (안노베니)이며 덩굴쪼김병이 상습적으로 발병하는 이현 미사질양토 (Ihyeon series, Coarse silty, mixed, mesic family of Dystric Fluventic Eutrochrepts) 포장에서 묘 큐어링 효과를 검토하였다. 처리내용은 큐어링을 위해 6~7마디의 25 cm 길이의 묘를 채취하여 저장온도 16°C, 상대습도 85%, 약광 조건에서 1일, 5일 저장 후 묘를 정식하였고, 대조구로 채묘 후 바로 정식하였다. 정식시기는 5월 25일에 휴간 75 cm, 주간 20 cm 간격으로 처리당 50주, 3반복으로 하였고 수확은 삽식 후 120일에 하였다. 시비량은 10a당 성분량으로 질소 5.5 kg, 인산 6.3 kg 및 칼리 15.6 kg을 전량 기비로 질소는 요소, 인산은 용성인비, 그리고 칼리는 황산칼리로 시비하였다. 기타 재배관리는 농촌진흥청 농업기술길잡이에 준하였다 (RDA, 2013). 시험전 토양 화학성은 pH 6.6, EC 0.19 dS m-1, 유기물 20 g kg-1, 유효인산 305 mg kg-1, 치환성 칼륨 0.48 cmolc kg-1, 치환성 칼슘 8.6 cmolc kg-1, 치환성 마그네슘 2.6 cmolc kg-1, 질산태 질소 4 mg kg-1의 전형적인 밭토양의 특징을 나타냈다.
토양 화학성분 분석방법
시험 전과 수확기 토양 화학성분 분석을 위하여 토양은 처리구 마다 3개소의 표토를 1 cm정도 걷어내고 0~15 cm 깊이에서 1 kg 정도를 3반복으로 채취하였다. 토양시료는 음지의 실험실에서 플라스틱 평판위에 얇게 펴고 7일간 건조하여 고무망치로 입자를 분쇄한 후 2 mm 체를 통과된 것을 분석에 사용하였다. 토양의 화학성분은 토양화학분석법 (NIAS, 2010)을 적용하여 분석하였다. 토양의 pH와 EC는 토양 10 g에 50 mL 증류수를 가하여 1:5 비율로 희석하고 비이커를 가끔씩 저어주면서 1시간 정치한 후 pH meter (Orion 520A pH meter, Orion Research Inc., Boston, USA)와, EC meter (Orion 3STAR EC meter, Orion Research Inc., Boston, USA)로 분석하였다. 유기물은 Tyurin법, 유효인산은 Lancaster법으로 비색계 (UV-1650PC, Shimadzu Co., Kyoto, Japan)를 사용하여 분석하였다. 치환성 칼륨, 칼슘 및 마그네슘 등의 양이온은 1M NH4OAc로 추출하여 ICP (Optima 5300DV, Perkin-Elmer, Norwalk, USA)로 분석하였고 질산태 질소는 킬달법으로 정량하였다.
토양 미생물 군집 분석
수확기 고구마 재배토양의 미생물 함량과 군집은 습토를 사용하여 Schutter and Dick (2000)의 방법으로 미생물 세포벽 지방산인 fatty acid methyl ester (FAME)를 분석하였다 (Kim et al., 2014; Moon et al., 2016; Igalavithana et al., 2017). 미생물의 함량과 군집 분석은 GC Agilent 6890N (Agilent Technologies, USA)과 HP-ULTRA 2 capillary column (25 m × 0.2 mm × 0.33 µm film thickness, Agilent Technologies, USA)을 사용하였다. 그리고 Internal standard 19:0을 이용하여 상대적인 지방산 함량과 비율을 계산하였다 (Hamel et al., 2006; Kim et al., 2014).
통계분석
고구마의 수량과 생육상황, 토양 화학성과 미생물 함량과 군집은 SAS 프로그램 9.1.3 버젼 (2006)을 사용하여 Duncan's multiple range test를 수행하였다. 그리고 고구마 수량과 덩굴쪼김병 발생률, 미생물 군집의 주성분 분석을 통하여 큐어링처리 효과를 검토하였다.
Results and Discussion
토양 화학성 변화
고구마 큐어링처리에 따른 수확기 토양 화학성분은 모든 처리구에서 유의적인 차이가 없었다. 이러한 결과는 화학비료나 유기물 공급 등 양분투입이 동일하기 때문에 토양 화학성 변화에 미치는 영향이 적은 것으로 판단되었다. 토양 pH는 시험전 토양과 비슷한 6.5에서 6.6의 수치를 나타냈으며 EC는 시험전 0.19 dS m-1 보다 낮은 0.15 dS m-1에서 0.17 dS m-1였다. 토양의 유기물 함량에 따른 차이도 크게 없었고 토양의 유효인산 함량은 시험전 토양에 비해 낮은 215에서 221 mg kg-1의 함량을 보였다. Osaki et al. (1995)은 고구마 수량은 K > N > P 순으로 영향을 많이 받으며 칼륨이 부족할 경우 인산 흡수를 제한하는 것으로 보고하였으나 본 연구에서 치환성 칼륨 함량은 0.21에서 0.25 cmolc kg-1, 질소 함량은 2.9에서 5.2 mg kg-1의 함량으로 큐어링처리에 따른 유의적인 차이가 없었다.
Table 1. Soil chemical properties of different curing treatments for sweet potato cultivation.
|
| Curing | pH | EC | OM | Avail. P2O5 | Exch. cation | NO3-N |
| K | Ca | Mg |
| (1:5) | dS m-1 | g kg-1 | mg kg-1 | ------ cmolc kg-1 ------ | mg kg-1 |
| Control | 6.5a† | 0.17a | 20a | 221a | 0.22a | 6.5a | 1.8a | 5.2a |
| Curing 1 day | 6.6a | 0.16a | 18a | 215a | 0.21a | 6.1a | 1.6a | 2.9a |
| Curing 5 days | 6.6a | 0.15a | 17a | 221a | 0.25a | 6.1a | 1.7ab | 4.0a |
†Means followed by different letters within the same row are significantly different at a 0.05 significance level. according to Duncan’s multiple range test.
고구마 생육 및 수량
수확기 고구마 생육과 수량은 Table 2와 같다. 고구마의 주만장은 큐어링 처리일수가 길어질수록 유의적으로 줄어드는 경향이었으며 주당 경엽중도 동일한 결과를 보였다 (p < 0.05). 주당 분지수는 무처리구가 4.2개, 큐어링 1일 처리구가 4.1개로 큐어링 5일 처리구 3.7개 보다 유의적으로 많았다 (p < 0.05). 그러나 고구마 덩굴쪼김병 발병률은 무처리구가 53.8%로 가장 높았으며 큐어링 1일 처리구 21.3%, 큐어링 5일 처리구 5.0% 순으로 낮아졌다 (p < 0.05). 이러한 결과는 큐어링을 2~3일 동안 처리할 경우 덩굴쪼김병을 효과적으로 방제할 수 있다는 Lee et al. (2002)의 결과와 일치하였다. 상품가치가 있는 주당 상저수는 큐어링 5일 처리구가 4.3개로 가장 많았으며 큐어링 1일 처리구는 3.2개, 무처리구는 2.3개를 나타났으며 덩굴쪼김병의 발병에 따른 영향을 받은 것으로 판단되었다. 상저중은 큐어링 1일 처리구가 241 g, 5일 처리구가 236 g으로 큐어링 처리일수에 따른 유의적인 차이가 없었으나 큐어링 처리구는 무처리구 214 g 보다 유의적인 차이를 나타냈다 (p < 0.05). 지상부와 지하부의 비율은 무처리구가 3.3으로 가장 높았으며 큐어링 1일 처리구는 2.0, 5일 처리구는 1.2의 비율로 큐어링 처리일수가 길어질수록 낮아지는 경향이었다.
Table 2. Effect of different curing treatments on the growth and yield of sweet potato.
|
| Curing | Vine
lengh | Branch number | Plant
weight | Marketable
root number | Marketable
root weight | Fusarium wilt | Top/Root | Yield |
| cm | no. plant-1 | g plant-1 | no. plant-1 | g | % | | kg 10a-1 |
| Control | 254a† | 4.2a | 4,141a | 2.3c | 214b | 53.8a | 3.3a | 1,262c |
| Curing 1 day | 231ab | 4.1a | 3,609b | 3.2b | 241a | 21.3b | 2.0b | 1,803b |
| Curing 5 days | 213b | 3.7b | 3,175c | 4.3a | 236ab | 5.0c | 1.2c | 2,698a |
†Means followed by different letters within the same row are significantly different at a 0.05 significance level. according to Duncan's multiple range test.
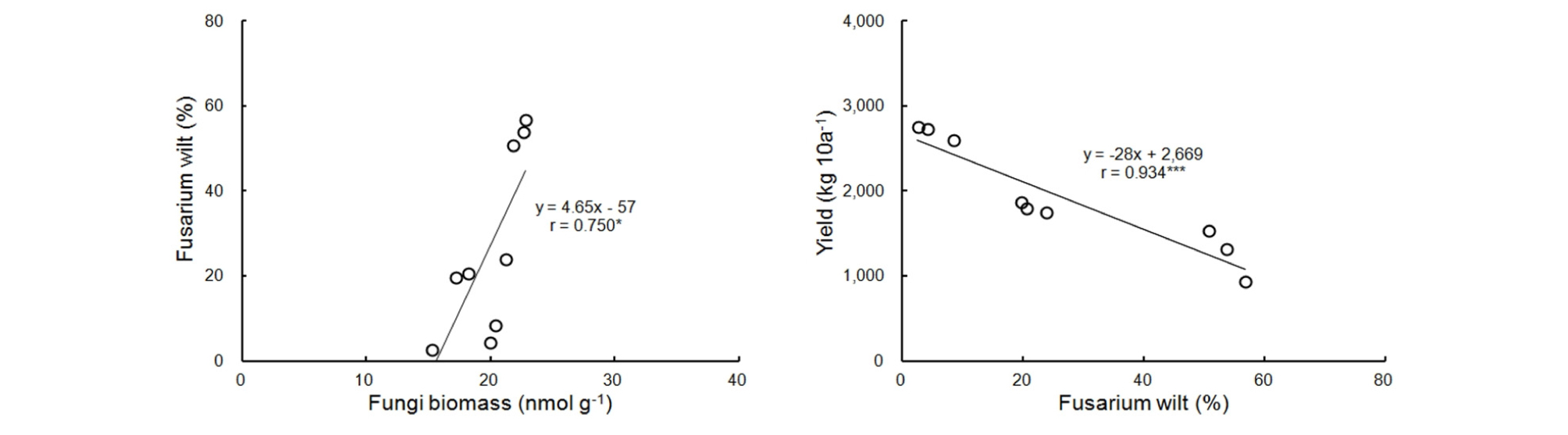
고구마의 수량은 덩굴쪼김병 발병이 낮은 큐어링 5일 처리구가 2,698 kg 10a-1로 무처리구 1,262 kg 10a-1 보다 114% 증가되는 효과가 있었으며 큐어링 1일 처리구도 무처리구에 비해 43% 증대되었다. Jung et al. (2001)은 덩굴쪼김병 발병으로 고구마의 수량이 75%정도 감소된다고 하였는데 본 연구에서도 덩굴쪼김병 발병으로 고구마의 수량이 감소되는 경향이었으며 큐어링 5일 처리구에 비해 무처리구가 53%의 수량 감소를 보였다 (Fig. 1).
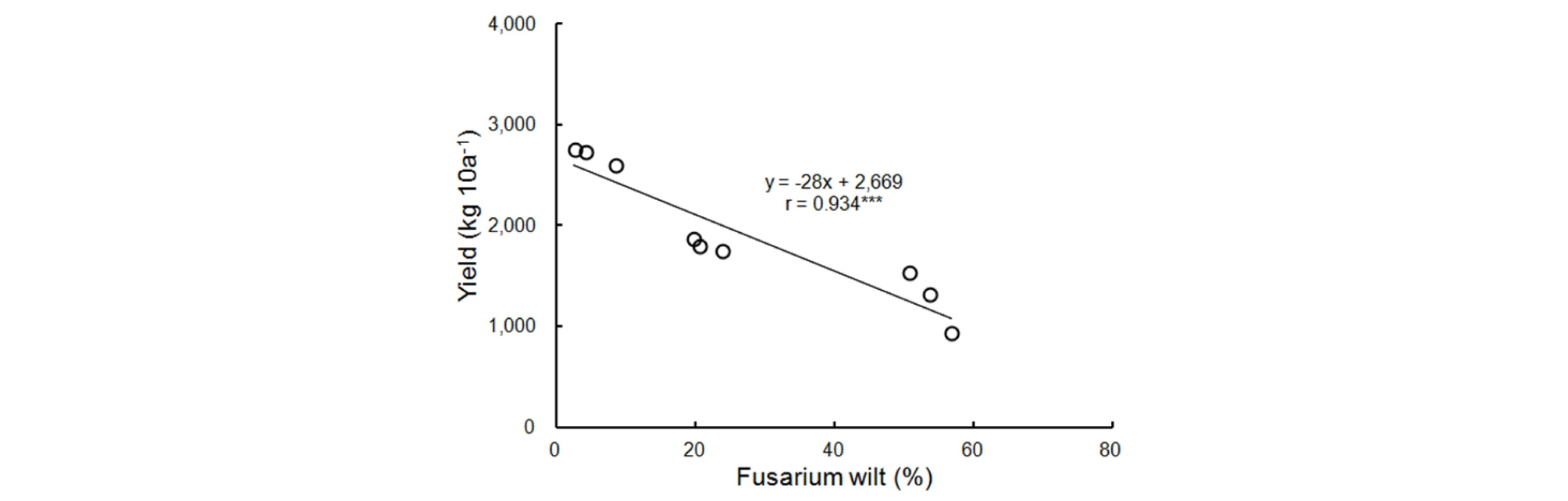
Fig. 1.
Correlation between Fusarium wilt and yield of sweet potato.
토양 미생물 함량 및 군집
수확기 고구마 재배 토양의 미생물 함량은 Table 3과 같다. 큐어링 처리구의 곰팡이 함량은 18.5 nmol g-1에서 18.8 nmol g-1으로 무처리구 22.4 nmol g-1에 비해 유의적으로 낮은 결과를 보였다. 이러한 결과는 덩굴쪼김병의 발병과 유의적인 정의 상관관계가 있는 것으로 판단된다 (Fig. 2). 고구마 덩굴쪼김병의 원인균은 Fusarium oxysporum으로 발병률이 높은 무처리구에서 원인균인 곰팡이의 함량이 높은 것으로 판단되었다 (Fravel et al., 2003). 토양의 미생물체량을 나타내는 총 FAME, 총세균, 그람음성세균, 그람양성세균, 방선균 및 내생균근균 함량은 큐어링 처리구와 무처리구 사이에 유의적인 차이가 없었다.
Table 3. Soil microbial biomass of different curing treatments for sweet potato cultivation.
|
| Curing | TF† | B | G (-) | G (+) | A | F | AMF |
| ------------------------------------- nmol g-1 ------------------------------------- |
| Control | 111a‡ | 31.1a | 15.1a | 13.8a | 1.4a | 22.4a | 5.9a |
| Curing 1 day | 106a | 32.1a | 13.7a | 15.8a | 1.5a | 18.8b | 3.7a |
| Curing 5 days | 120a | 34.7a | 15.1a | 17.0a | 1.5a | 18.5b | 5.6a |
†TF, total FAMEs; B, total bacteria; G (-), gram-negative bacteria; G (+), gram-positive bacteria; A, actinomycetes; F, fungi; AMF, arbuscular mycorrhizal fungi.
‡Means followed by different letters within the same row are significantly different at a 0.05 significance level. according to Duncan’s multiple range test.
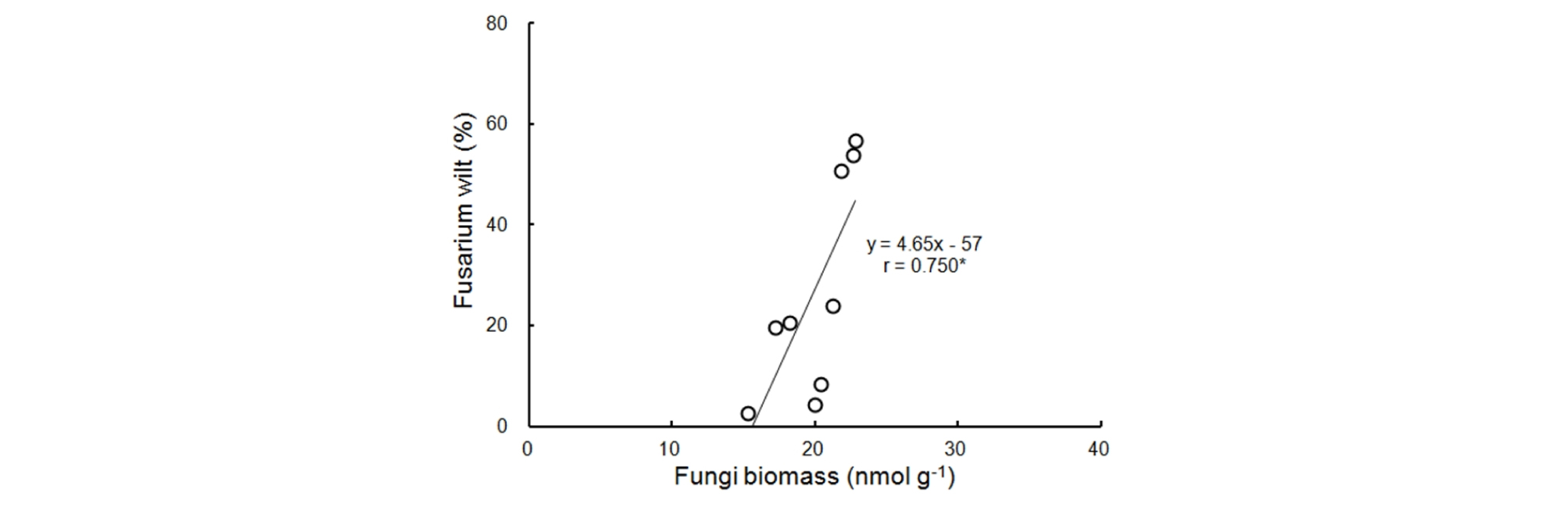
Fig. 2.
Correlation between soil fungal biomass and Fusarium wilt of sweet potato.
수확기 토양 미생물 군집을 분석한 결과는 Table 4와 같다. 그람양성세균은 큐어링 1일 처리구가 14.8%, 5일 처리구가 14.2% 로서 무처리구 12.5% 에 비해 유의적으로 많았다 (p < 0.05). 그러나 곰팡이 세균 군집은 무처리구가 20.5%로 서 큐어링 1일 처리구 18.0%, 큐어링 5일 처리구 15.6%에 비해 유의적으로 많았다 (p < 0.05). Lee and Yun (2011)은 밭토양에서 그람양성세균 군집과 곰팡이 군집은 부의 상관관계를 나타낸다고 하였는데 본 연구에서도 유사한 결과를 나타냈다. 큐어링 처리에 따른 토양의 총세균, 그람음성세균, 방선균, 내생균근균의 군집은 무처리와 유의적인 차이가 없었다.
Table 4. Soil microbial communities of curing treatments for sweet potato cultivation.
|
| Curing | B† | G (-) | G (+) | A | F | AMF |
| ---------------------------------------- % ---------------------------------------- |
| Control | 28.0a‡ | 13.7a | 12.5b | 1.3a | 20.5a | 5.3a |
| Curing 1 day | 30.0a | 12.8a | 14.8a | 1.4a | 18.0b | 3.4a |
| Curing 5 days | 29.0a | 12.6a | 14.2a | 1.2a | 15.6b | 4.7a |
†B, total bacteria; G (-), gram-negative bacteria; G (+), gram-positive bacteria; A, actinomycetes; F, fungi; AMF, arbuscular mycorrhizal fungi.
‡Means followed by different letters within the same row are significantly different at a 0.05 significance level. according to Duncan’s multiple range test.
주성분 분석
큐어링 처리일수에 따른 수확기 토양의 미생물 군집과 덩굴쪼김병 및 고구마 수량의 주성분 분석결과는 Fig. 3과 같다. 주성분 분석결과 제1주성분이 50.1%, 제2주성분이 22.7%로서 전체 72.8%의 자료를 설명할 수 있는 것으로 나타났다. 제1주성분은 고구마 수량과 관련된 것으로 덩굴쪼김병 발병률이 가장 크게 기여하였고, 그람양성세균 군집, 수량, 곰팡이 군집의 순으로 기여를 하였다. 그리고 제2주성분은 방선균 군집, 총세균 군집, 그람음성세균 군집, 내생균근균 군집의 순으로 기여를 하였다. 주성분 분석결과로 PC1에서 큐어링 처리구는 무처리구와 비교하면 발병률과 고구마 수량에 대하여 유의적인 차이가 있었다 (p < 0.05). 향후적인 연구에서는 세부적인 큐어링 처리일수와 조건, 처리시기 등에 따른 토양 미생물의 군집 변화와 고구마 수량에 미치는 영향을 지속적으로 모니터링 해야 할 것으로 판단된다.
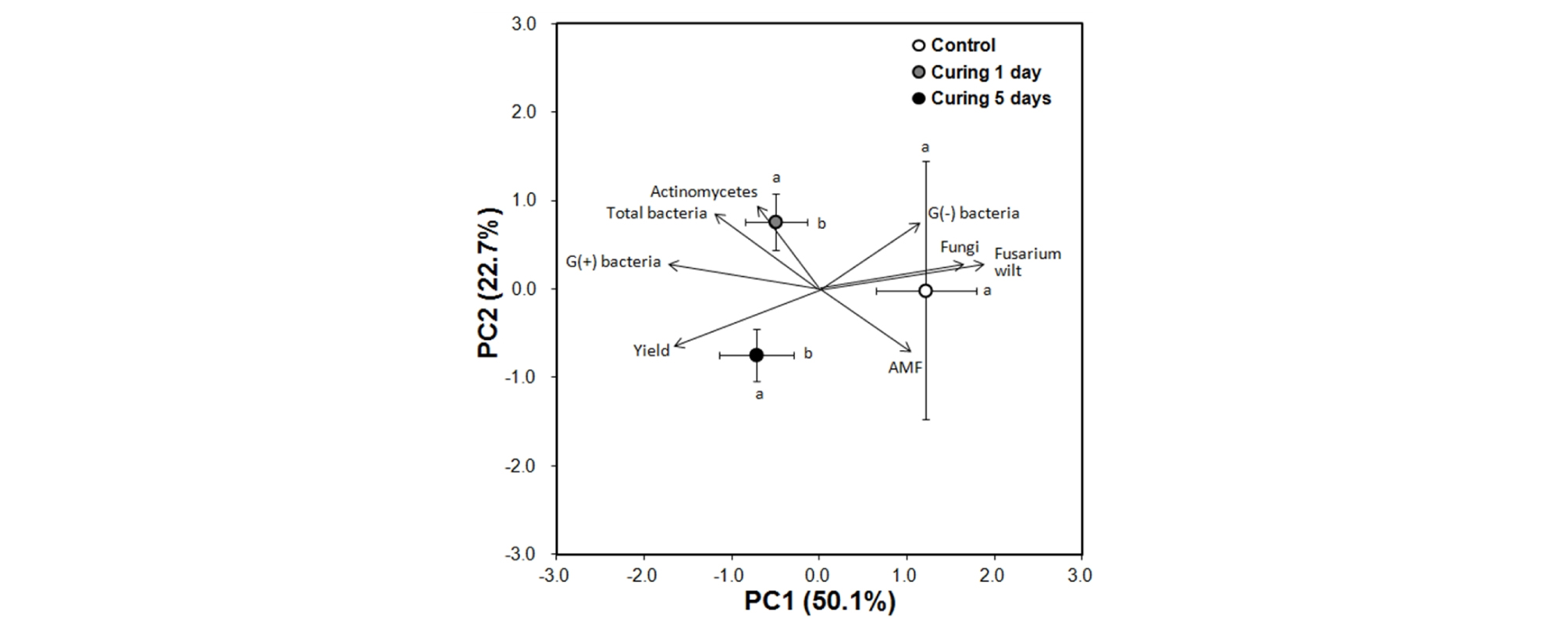
Fig. 3.
Principal component analyses between microbial communities of different curing treatment soils for sweet potato cultivation. The variance explained by each principal component (PC) axis is shown in parentheses. PC analysis shows loading values for the individual microbial biomarkers. The bars represent one standard deviation of the mean. Means by the same letter within a column are not significantly different at 0.05 probability level according to Duncan's multiple range test.
Conclusion
고구마 덩굴쪼김병을 효과적으로 방제하기 위하여 큐어링 처리일수별 토양환경과 수량에 미치는 영향을 검토하였다. 본 연구결과로서 큐어링 처리는 토양의 곰팡이 밀도와 군집을 감소시키는 것으로 나타났으며 덩굴쪼김병 발병률을 낮추는 효과가 있었다. 또한, 지상부와 지하부의 비율을 조절하여 주당 상저수가 많아지고 수량이 증대되었다. 이러한 결과로 볼 때 고구마 줄기의 큐어링 처리는 덩굴쪼김병을 효과적으로 방제할 수 있는 방법으로 판단된다.
Acknowledgements
This work was carried out with the support of “Cooperative Research Program for Agriculture Science & Technology Development (Project No. PJ011759072018)” Rural Development dministration, Republic of Korea.
References
Aidoo, K.E. 1993. Post harvest storage and preservation of tropical crops. Int. Biodeter. Biodegrad. 32:161-173.
Booth, R.H. 1974. Post-harvest deterioration of tropical root crops: Losses and their control. Trop. Sci. 16:49-63.
Clark, C.A. and J.W. Moyer. 1988. Compendium of sweet potato diseases. APS Press, St. Paul, MN, p.74.
Fravel, D., C. Olivain, and C. Alabouvette. 2003.
Fusarium oxysporum and its biocontrol. New Phytol. 157:493-502.
Hamel, C., K. Hanson, F. Selles, A.F. Cruz, R. Lemke, B. McConkey, and R. Zentner. 2006. Seasonal and long-term resource-related variations in soil microbial communities in wheat-based rotations of the Canadian prairie. Soil Biol. Biochem. 38:2104-2116.
Harter, L.L. and E.C. Field. 1914. The stem-rot of the sweet potato (
Ipomoea batatas). Phytopathol. 4:279-304.
Harter, L.L. and W.A. Whitney. 1927. Relation of soil temperature and soil moisture to the infection of sweet potatoes by the stem rot organisms. J. Agric. Res. 34:435-441.
Igalavithana, A.D., S.E. Lee, Y.H. Lee, D.C.W. Tsang, J. Rinklebe, E.E. Kwon, and Y.S. Ok. 2017. Heavy metal immobilization and microbial community abundance by vegetable waste and pine cone biochar of agricultural soils. Chemosphere 174:593-603.
Jeong, B. C. 1996. Effects of preliminary treatments on vine cuttings before transplanting on growth and yield in sweet potato. RDA J.Agri. Sci. 38: 129-134.
Jung, B.C., H.K. Shim, and Y.H. Lee. 2001. 10 measures to control Fusarium wilt in sweet potato. Research and Extension 42:16-19.
Jung, S.T., J.W. Rhim, and S.G. Kang. 1998. Quality properties and carotenoid pigments of yellow sweet potato puree. J. Korean Soc. Food Sci. Nutr. 27: 596-602.
Kim, J.S. 1995. Preparation of sweet potato drinks and its quality characteristics. J. Korean Soc. Food Nutr. 24: 943-947.
Kim, M.K., Y.S. Ok, J.Y. Heo, S.L. Choi, S.D. Lee, H.Y. Shin, J.H. Kim, H.R. Kim, and Y.H. Lee. 2014. Analysis of soil microbial communities formed by different upland fields in Gyeongnam Province. Korean J. Soil Sci. Fert. 47:100-106.
Lee, Y.H. and H.D. Yun. 2011. Changes in microbial community of agricultural soils subjected to organic farming system in Korean paddy fields with no-till management. J. Korean Soc. Appl. Biol. Chem. 54(3):434-441.
Lee, Y.H., K.H. Cha, D.G. Lee, H.K. Shim, S.J. Ko, I.J. Park, and K.Y. Yang. 2004. Cultural and rainfall factors involved in disease development of Fusarium wilt of sweet potato. Plant Pathol. J. 20:92-96.
Lee, Y.H., K.H. Cha, S.J. Ko, I.J. Park, and K.Y. Yang. 2002. Control of sweet potato fusarium wilt with benomyl and hardening of vine cuttings. The Korean Society of Plant Pathology Autumn Symposium. p. 63-64.
McClure, T.T. 1949. Mode of infection of the sweet-potato wilt Fusarium. Phytopathology 39:876-886.
Moon, J.Y., J.K. Song, J.H. Shin, Y.C. Cho, J.W. Bae, J.Y. Heo, H.W. Kang, and Y.H. Lee. 2016. Effect of biodegradable mulch film on soil microbial community. Korean J. Soil Sci. Fert. 49:125-131.
Nakatanni, M, A. Oyanagi, and Y. Watanabe. 1987. Holding of cut-sprouts in sweet potato (Ipomoea batatas LAMK) : I. Effects of holding on rooting of cut-sprouts. Jpn. J. Crop Sci. 56: 238-243.
Nakatanni, M, A. Oyanagi and Y. Watanabe. 1987. Holding of cut-sprouts in sweet potato (Ipomoea batatas LAMK) : II. Physiological changes in cut-sprouts during the holding period. Jpn. J. Crop Sci. 56: 244-251.
NIAS (National Institute of Agricultural Sciences). 2010. Methods of soil chemical analysis. Suwon, Korea.
Ogawa, K. 1988. Studies on Fusarium wilt of sweet potato (
Ipomoea batatas L.) Bulletin of the National Agriculture Research Center 10:1-127.
Osaki, M., H. Ueda, T. Shinano, H. Matsui, and T. Tadano. 1995. Accumulation of carbon and nitrogen compounds in sweet potato plants grown under deficiency of N, P, or K nutrients. Soil. Sci. Plant Nutr. 41:557-566.
Park, I.S., H.J. Lee, M.K. Lee, and I.S. Park. 2006. Characterization of mushroom tyrosinase inhibitor in sweet potato. J. Life Sci. 16: 396-399.
Park, J.S. 1967. Fungus diseases of plants in Korea. A paper collection of Chungnam National University 6:51.
SAS Institute. 2006. SAS Version 9.1.3. SAS Inst., Cary, NC.
Schutter, M.E. and R.P. Dick. 2000. Comparison of fatty acid methyl ester (FAME) methods for characterizing microbial communities. Soil Sci. Soc. Am. J. 64:1659-1668.
Shin, M.Y., K.S. Youn, S.W. Lee, H.K. Moon, and W.Y. Lee. 2011. Optimization of vacuum drying conditions for a steamed (pumpkin-) sweet potato slab by response surface methodology. J. Korean Soc. Food Sci. Nutr. 40:1314-1320.
Van Oirschot, Q.E.A., D. Rees, J. Aked, and A. Kihurani. 2006. Sweetpotato cultivars differ in efficiency of wound healing. Postharvest Biol. Technol. 42:65-74.
Yoo, K.R. and S.Y. Lee. 2013. Growth characteristics and yield of sweet potato cultivars between virus-free and farmer’s slips in late season cultivation. Korean J. Crop Sci. 58:43-49.