Introduction
건강에 대한 관심이 고조되면서 채소 등 별도의 가공처리 없이 섭취하는 신선 농산물에 대한 소비가 꾸준히 증가하고 있다 (Ahn et al., 1999). 최근 신선 채소류, 과일류, 비멸균 주스 등으로 인한 식중독 사고는 증가하고 있다 (Beuchat, 2001). 식중독균은 식물체 표면에 존재하고 특정한 환경조건에서는 식물체에 부착하거나 생존할 수 있다 (Bernstein et al., 2007). 외국에서 멜론, 망고, 새싹, 로메인 상추, 토마토, 시금치, 고추 등 농산물에 의한 식중독 사고는 최근 빈번히 발생하고 있다 (CDC, 2018). 영국에서는 부추에 존재하는 E. coli O157:H7에 의한 식중독 사고로 74명이 입원하였고 1명이 사망하였다 (Powell, 2011). 병원성 대장균에 오염된 상추로 인한 식중독 사고도 미국에서 발생하였다 (Ackers et al., 1998). 오염된 미생물은 수확 후 소비되기 전의 저장기간 동안 신선 농산물에서 증식하여 사람에게 식중독을 일으킬 수 있다. 식중독 사고를 일으키는 병원성 미생물은 토양, 오염된 관개수, 가축분변, 먼지, 미숙 퇴비 등에 존재할 수 있고, 수확하기 전 몇 가지 경로로 농산물을 오염시킬 수 있다 (Burnett et al., 2001). 특히 부숙이 충분히 되지 않은 가축분 퇴비는 재배단계의 농산물 오염의 가장 큰 오염원이다 (Solomon et al., 2002). 농산물 중 근채류와 엽채류는 미부숙 퇴비에 의한 식중독균 오염에 가장 취약할 수 있다 (Buck et al., 2003).
가축분변 유래 장내세균의 생존이나 증식은 식물뿌리에서 나오는 유기물 또는 근권 주위의 미생물에 영향을 받을 수 있고 병원균, 토양 미생물, 토양, 식물체 뿌리의 상호작용의 영향을 받을 수도 있다 (Jiang and Shepherd, 2009). 관개수, 퇴비 등의 농자재 등을 통해 식중독세균이 토양으로 유입될 수 있으며, 토양 내에서 오랫동안 생존하여 오염이 발생할 수 있다 (Ibenyassine et al., 2006). Jung et al. (2017)은 배추재배 토양에서 대장균이 검출된다고 하였다. Erickson et al. (2010)은 E. coli O157:H7에 오염된 관개수를 토양에 접종한 결과 76일 동안 생존하였다고 하였다. 병원성 대장균은 토양과 퇴비에서 각각 154일, 217일 생존할 수 있다고 하였다 (Islam et al., 2004). E. coli O157:H7은 토양에서 생존하고 증식할 수 있으며 가축분 퇴비는 E. coli O157:H7의 생존 능력을 더욱 증가시킬 수 있다고 하였다 (Gagliardi and Karns, 2000). Holley et al. (2006)은 가축분 퇴비를 토양에 추가하였더니 Salmonella spp.가 더 오래 생존하였다고 하였다. 퇴비가 시용된 토양에서 상추를 재배하였을 경우, Salmonella는 231일까지 생존하였고, S. enterica는 상추 재배토양에서 63일까지, 파슬리 재배토양에서 231일까지 생존하였다 (Islam et al. 2004). Gagliardi and Karns (2002)은 E. coli O157:H7이 휴경 토양에서 47일까지 생존할 수 있고, 호밀 뿌리에서 96일, 알팔파 뿌리에서 92일까지 생존 가능하다고 하였다. 병원성 미생물에 오염된 토양이나 퇴비가 농산물에 접촉되어 사람이 오염 농산물을 섭취하면 식중독이 발생할 수 있다 (Morgan et al., 1988). 본 연구는 국내 토양과 가축분 퇴비가 섞인 토양에서 병원성 미생물 (S.enterica,E. coli O157:H7,L. monocytogenes)의 생존능 및 생존기간을 비교‧분석하고, 또한 병원성 미생물의 생존기간과 생존에 미치는 퇴비의 영향을 분석함으로써 농산물 안전관리를 위한 기초자료를 제공하고자 수행하였다.
Materials and Methods
사용균주 및 시료채취
국내 축산의 주요 축종인 돼지의 분뇨를 주원료로 생산, 유통되는 가축분 퇴비를 수집하였고 접종 균주로 ATCC에서 분양받은 S. enterica ATCC 13311, E. coli O157:H7 ATCC 43895, L. monocytogenes ATCC 15313를 사용하였다. 사용된 균주는 tryptic soy broth (Difco Co., Detroit, MI, USA)에 접종한 후 진탕배양기 (VS 8480, Vision Science, Korea)를 이용하여 37°C, 250-280 rpm에서 18시간 배양하였다. 배양액은 10,000 rpm에서 2분간 원심분리하여 상층액은 버리고 0.1% buffered peptone water (Difco Co., Detroit, MI, USA) 20 mL을 가한 후 washing 과정을 2회 실시한 다음 세균수가 약 108 CFU mL-1이 되도록 농도를 맞추어 사용하였다. 본 실험에서는 경기도 수원에 위치한 서울대 농대 실험포장에서 노지 토양의 0-15 cm 표토 깊이에서 채취한 토양을 사용하였으며 토양은 2 mm (#10 mesh) 스테인레스 체로 걸러 최대한 균질하도록 조성한 다음, 121°C에서 30분간 2회 고압멸균을 하여 멸균상태로 상온에 두었다. 토양과 퇴비는 멸균처리하였으며 멸균된 토양과 가축분 퇴비 (250 g)를 첨가한 토양 각각 500 g을 멸균된 polypropylene box (2.3L, Locknlock co., Korea)에 넣고, 균주현탁액 50 mL을 가한 후 스푼으로 골고루 섞어 균질화하였다. 사전 실험을 통해 polypropylene box (Locknlock)의 수분손실이 거의 일어나지 않는 것을 확인하였고, 같은 수준의 토양 수분함량 (15%), 퇴비 수분함량 (58%)으로 실험을 하였다. 토양과 가축분 퇴비에 유해미생물 접종 후 수분손실을 막기 위하여 밀봉상태를 유지하면서 25°C의 incubator (VS 1203 PFC, Vision Science, Korea)에서 200일 동안 배양하면서 매주에 1회씩 주기적으로 시료를 채취하여 시험을 실시하였고 시료채취 시 외부오염을 막기 위하여 클린벤치 (CLB-201-04, CHC Lab, Korea)에서 작업하였다. 시험에 사용한 토양과 퇴비의 이화학적 특성은 Table 1, 2과 같다.
Table 1. Chemical properties of the soil used in the experiment.
| pH (1:5) | OM (g․kg-1) | Av.P2O5 (mg․kg-1) | Exch.(cmol(+) kg-1) | NH4 (mg․kg-1) | T-N (%) | |||
| K | Ca | Mg | Na | |||||
| 6.4 | 14 | 181 | 0.22 | 6.6 | 2.4 | 0.1 | 10 | 0.11 |
Table 2. Chemical properties of livestock manure compost used in the experiment.
| pH | C/N ratio | OM | T-N | T-P2O5 | T-K2O | T-CaO | T-MgO |
| -----------------------------------------(%) ----------------------------------------- | |||||||
| 5.48 | 45.00 | 81.70 | 0.75 | 0.67 | 0.69 | 0.61 | 0.33 |
유해미생물 계수
S. enterica, E. coli O157:H7, L. monocytogenes의 분리는 채취한 시료를 균질화한 뒤 3 g을 취해서 buffered peptone water (Difco Co., Detroit, MI, USA) 27 mL에 접종한 후 stomacher (easyMIX, AES CHEMUNEX, France)로 2분 동안 균질화하였다. 균질화 된 시료는 buffered peptone water (Difco)를 이용하여 10배씩 연속 희석하였다. S. enterica, E. coli O157:H7, L. monocytogenes의 정량적 분석을 위해서 앞에서 준비한 시료 1 mL를 xylose lysine deoxycholate agar (Difco), macconkey sorbitol agar (Difco), oxford agar (Difco)위에 각각 도말하여 37°C에서 24-48시간 배양하였다. 배양 후 각 배지 위에 형성된 colony를 계수하여 colony forming unit (CFU) g-1으로 나타내었다. 의심집락은 세균부유액과 반응한 산물의 색변화로 판단하는 API test (bioMerieux, Marcy 1’Etoile, France), 항원항체의 응집반응결과로 판단하는 Latex test (Oxoid Ltd., Hampshire, UK)을 수행하여 동정하였다.
DRT 측정식
미생물이 90% 사멸하는 데 걸리는 시간인 DRT (decimal reduction time) 값은 다음과 같은 식에 적용하여 계산하였다 (Himathongkham et al., 1999). Regression equation은 Microsoft Excel 프로그램을 이용하여 구하였다.
| $$DRT=\log(N_0/N)t$$ | (Eq. 1) |
N0: 미생물의 초기밀도, N: 미생물의 최종밀도, t: 시간
Results and Discussion
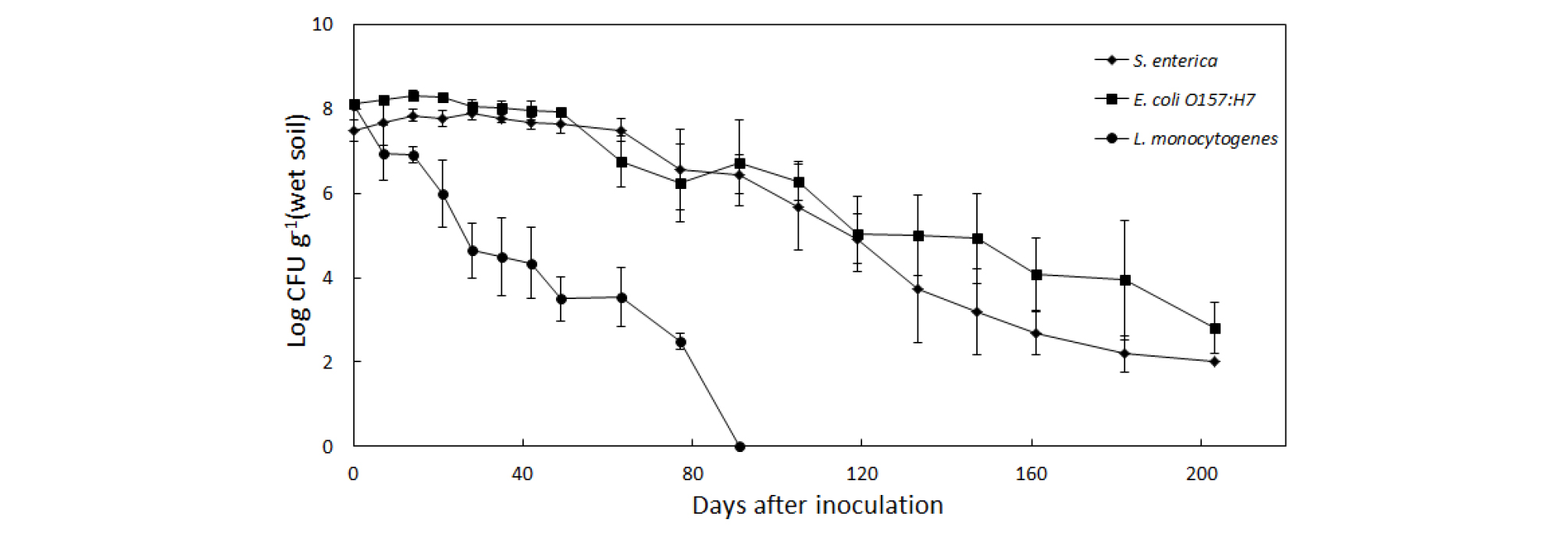
토양에서 유해미생물의 생존변화
토양과 가축분 퇴비에 존재하는 미생물이 병원성 미생물의 생존에 미치는 영향을 배제하기 위하여 토양과 퇴비는 멸균처리 하였다. 토양에 S. enterica, E. coli O157:H7, L. monocytogenes를 접종하여 유해미생물 종류에 따른 생존 변화양상을 조사한 결과 (Fig. 1 Fig. 1. Survival of S. enterica, E. coli O157:H7, and L. monocytogenes in soil at 25°C (n = 9, error bars = SD). ), 같은 토양과 온도 (25°C)에서 유해미생물의 생존양상은 유해미생물별로 다른 경향을 나타내었는데 E. coli O157:H7이 가장 오래 생존하였고, L. monocytogenes은 가장 빨리 사멸하였다. E. coli O157:H7에서 0-50일까지는 거의 변화가 없었고 그 이후로 200일까지 점점 감소하는 경향을 보였다. Ishii et al. (2006)은 대장균이 25°C 이하 토양에서 30일 이상 생존할 수 있다고 하였고, Maule (2000)은 E. coli O157:H7는 토양에서는 130일 동안 생존할 수 있다고 하였다. S. enterica에서 0-60일까지는 거의 일정한 수준을 유지하다가 60일 이후부터 200일까지 서서히 감소하였다. 병원성 미생물인 Salmonella는 가축분뇨에 발견될 수 있고 토양에서 160-200일까지 생존할 수 있다 (Holley et al., 2006). L. monocytogenes에서는 0-30일까지는 급격히 감소하다가 그 이후 60일까지는 약간 감소하였으나 60일 이후부터는 급격히 감소하여 90일 정도에는 전부 사멸하였다. Welshimer (1960)은 L. monocytogenes가 토양에서 67일 동안 생존할 수 있다고 하였는데 본 결과에서도 비슷한 생존기간을 나타내었다. 국내 토양에서 3종류의 병원성 미생물 중 E. coli O157:H7, S. enterica, L. monocytogenes 순으로 생존능력이 높았고 그 중 생존능이 높은 E. coli O157:H7와 S. enterica는 작물 재배 토양에 오염이 되지 않도록 특별한 주의가 필요하다고 생각한다. 작물재배 토양에 병원성 미생물이 존재한다면 장시간 생존할 수 있어 작물이 오염될 수 있다. 오염된 작물을 인간이 섭취하게 된다면 식중독 사고가 발생할 수 있으므로 농산물로 인한 식중독사고를 예방하기 위하여 재배환경을 청결하게 관리하는 것이 중요하다. Burnett and Buechat (2001)은 농산물이 병원성 미생물에 의해 오염될 수 있는데 그 오염원으로는 토양, 가축분뇨, 관개수, 먼지, 미숙퇴비 등이 있다고 하였다. 오염된 관개수를 사용하지 않고 퇴비를 충분히 부숙해서 사용하는 것이 농산물로 인한 식중독 사고를 예방하는 최선의 방법이라고 생각한다. 토양 내 S. enterica, E. coli O157:H7, L. monocytogenes의 DRT (decimal reduction time)값을 나타낸 것에서 E. coli O157:H7은 36.2일, S. enterica은 30.0일,L. monocytogenes은 13.0일이었다 (Table 3). Jay (2000)는 그람양성균이 그람음성균보다 양분요구도가 크기 때문에 같은 환경조건이라도 그람음성균보다 생존기간이 짧을 수 있다고 하였는데 본 결과에서도 그람음성균인 S. enterica와 E. coli O157:H7는 생존기간이 길었고 그람양성균인 L. monocytogenes는 생존기간이 짧은 경향을 보였다.
Table 3. Decimal reduction time (DRT) for S. enterica, E. coli O157:H7, and L. monocytogenes in soil and compost amended soil at 25°C.
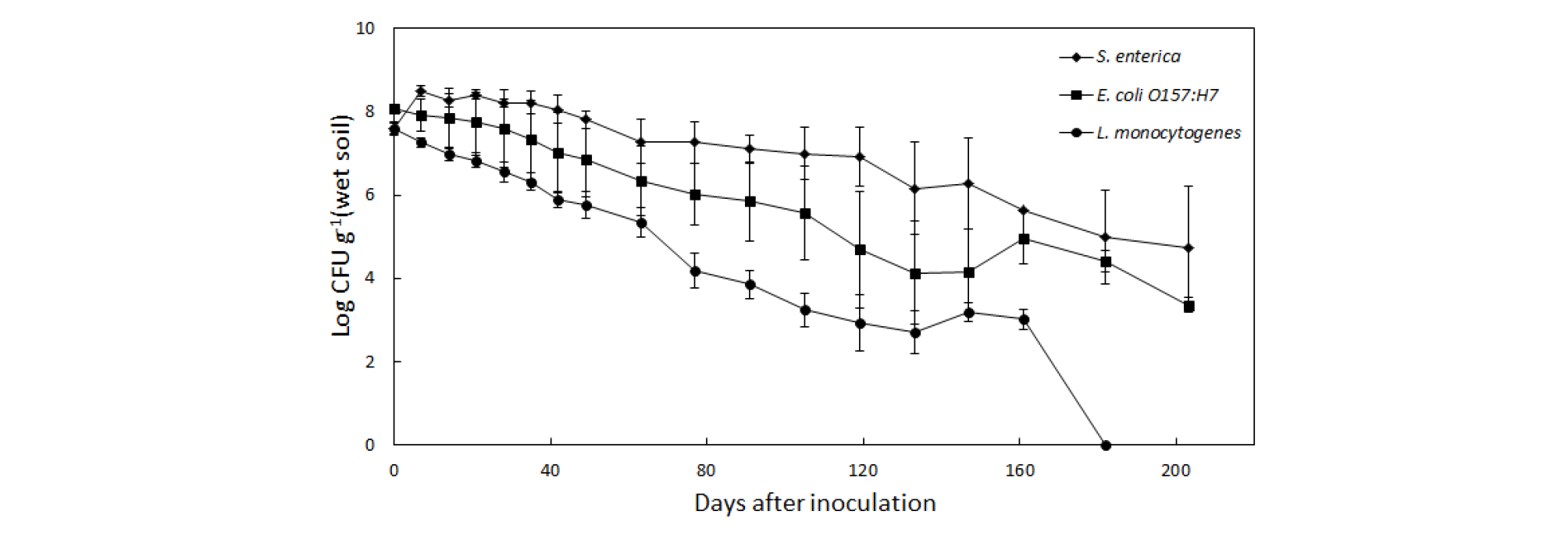
가축분 퇴비가 섞인 토양에서 유해미생물의 생존변화
가축분 퇴비가 섞인 토양에 S. enterica, E. coli O157:H7, L. monocytogenes를 접종하여 유해미생물 종류에 따른 생존 변화양상을 조사한 결과 (Fig. 2), 가축분 퇴비와 토양이 섞여 있는 상태 (25°C)에서 유해미생물의 생존양상은 유해미생물별로 다른 경향을 나타내었다. S. enterica에서 0-7일까지는 약간 증가하였고 그 이후부터 200일까지 서서히 감소하는 경향을 보였다. E. coli O157:H7에서 0-150일까지는 서서히 감소하다가 150-160일까지는 약간 증가 후 다시 감소하였다. L. monocytogenes에서는 0-160일까지는 점점 감소하였고 180일 정도에 모두 사멸하였다. 토양에서 병원성 미생물의 생존기간보다 가축분 퇴비가 섞인 토양에서 병원성 미생물의 생존기간이 좀 더 길어지는 결과를 볼 때 가축분 퇴비가 병원성 미생물의 생존에 유리하게 작용을 한다는 것을 알 수 있다. 퇴비에 포함되어 있는 유기물의 추가로 인해 병원성 미생물이 더 오래 생존했다고 생각한다. 수중에서 호기성균은 유기물이 많은 수질에서 급성장한다고 하였다 (Jang and Nam, 2017). 또한, S. enterica, E. coli O157:H7보다 L. monocytogenes가 가축분 퇴비의 영향이 더 크다는 것도 알 수 있다. 가축분 퇴비가 토양에 섞일 때 병원성 미생물의 수는 더욱 증가한다고 하였고 (Unc and Goss, 2004), E. coli O157:H7은 토양에서 생존하고 증식할 수 있으며 가축분 퇴비는 E. coli O157:H7의 생존 능력을 더욱 증가시킬 수 있다고 하였는데 (Gagliardi and Karns, 2000), 본 결과와 같았다. Kudva et al. (1998)은 양 (羊)의 분뇨로 생산한 퇴비에서 E. coli O157:H7이 4개월 동안 생존할 수 있다고 보고하였고 You et al. (2006)은 가축분 퇴비가 포함된 토양에서 Salmonella spp.는 332일까지 생존할 수 있다고 하였다. Jone (1986)은 소의 분변이 포함된 토양에서 Salmonella spp.가 300일 동안 생존하였고, 가축분뇨가 포함된 토양에서 256일 동안 생존했다고 보고하였다. 본 실험결과 중 약 5개월 이상 생존할 수 있는 결과로 볼 때 병원성 미생물이 우리나라에서 생산한 퇴비와 토양에서도 장기간 생존할 수 있다는 것을 보여주고 있다. 가축분뇨에는 S.enterica,E. coli O157:H7, L. monocytogenes 등의 병원성 미생물이 존재할 수 있다. 가축분뇨는 퇴비화과정을 거쳐 비료로 사용하고 있는데 충분히 부숙되지 않은 퇴비에는 병원성 미생물이 잔존할 수 있어 농산물 안전차원에서 위험요소가 될 수 있다. 퇴비가 섞인 토양에서 병원성 미생물은 오랜 기간 생존 가능하므로 토양이 병원성 미생물에 오염되지 않도록 하는 것이 중요하다. 부숙퇴비 사용, 오염되지 않은 관개수 사용, 농작업자의 청결한 위생, 야생동물 출입통제 등의 방법으로 오염예방 관리를 해야 한다고 생각한다. Table 3은 가축분 퇴비가 섞인 토양 내 S. enterica, E. coli O157:H7, L. monocytogenes의 DRT (decimal reduction time)값을 나타낸 것이다. S. enterica에서 56.8일, E. coli O157:H7에서 42.7일,L. monocytogenes에서 28.1일이었다.
Conclusion
본 연구는 국내 토양과 가축분 퇴비가 섞인 토양에서 병원성 미생물 (S.enterica,E. coli O157:H7,L. monocytogenes)의 생존능 및 생존기간을 비교, 분석하고 농산물의 안전성을 확보하기 위하여 안전한 가축분 퇴비의 생산과 이용에 도움을 주고자 수행하였다. 토양에 S. enterica, E. coli O157:H7, L. monocytogenes를 접종하여 유해미생물 종류에 따른 생존 변화양상을 조사한 결과, 같은 토양과 온도 (25°C)에서 유해미생물의 생존양상은 유해미생물별로 다른 경향을 나타내었는데 E. coli O157:H7이 가장 오래 생존하였고, L. monocytogenes은 가장 빨리 사멸하였다. 가축분 퇴비와 토양이 섞여 있는 상태 (25°C)에서 유해미생물의 생존양상은 유해미생물별로 다른 경향을 나타내었는데 S.enterica이 가장 오래 생존하였고, L. monocytogenes은 가장 빨리 사멸하였다. 토양에서 병원성 미생물의 생존기간보다 가축분 퇴비가 섞인 토양에서 병원성 미생물의 생존기간이 더 길어지는 결과를 볼 때 가축분 퇴비가 병원성 미생물의 생존 능력을 더욱 증가시켰다. 이는 퇴비의 유기물이 병원성 미생물의 영양원으로 작용했기 때문으로 생각한다. 병원성 미생물은 토양이나 퇴비에서 장시간 생존할 수 있고 작물을 오염시킬 수 있으므로 농산물로 인한 식중독 사고를 예방하기 위하여 병원성 미생물이 토양에 존재하지 않도록 관리하는 것이 중요하다.