Introduction
가축분뇨는 질소, 인 등의 영양물질과 유기물을 다량 함유하고 있어 적절한 처리를 거치지 않고 토양으로 환원될 경우 토양, 지표수, 지하수, 대기 등과 관련된 환경오염을 유발할 수 있다 (Rico et al., 2011; Córdoba et al., 2016). 국내에서 발생되는 가축분뇨의 약 80%는 퇴비화 방법에 의해 처리되고 있다 (Korea's Institute of Livestock Environmental Management, 2015). 가축분뇨 퇴비화 공정은 송풍 및 교반을 위해 많은 에너지를 요구할 뿐만 아니라 퇴비화 과정 중 영양물질의 손실 및 악취, 온실가스 발생 등의 단점이 있어 기존의 가축분뇨 퇴비화 시스템을 대체할만한 대안기술이 개발될 필요가 있다 (Sikora, 1998; Hao et al., 2001; Cuéllar and Webber, 2008; Miranda et al., 2016).
혐기소화는 가축분뇨 처리 과정에서 발생되는 악취 및 온실가스를 상당 부분 저감시킬 수 있으며, 혐기소화 잔존물은 작물에 필요한 비료로 이용될 수도 있다. 또한 혐기소화과정에서 발생된 바이오가스는 대체에너지로 활용 가능해 혐기소화는 환경친화적 기술로 분류되는 등 다양한 장점이 있어 기존의 가축분뇨 퇴비화 시스템의 대안기술로 활용될 수 있다고 본다 (Batstone, 2000; Angelidaki et al., 2004; Krich et al., 2005; Mandeno et al., 2005; Cuéllar and Webber, 2008; Ward et al., 2008; Eskicioglu and Ghorbani, 2011; Miranda et al., 2016).
혐기소화 시스템은 일반적으로 처리하는 기질의 수분함량에 따라 액상혐기소화 (L-AD; Liquid anaerobic digestion)와 고상혐기소화 (SS-AD; Solid-state anaerobic digestion)시스템으로 구분된다. 고상혐기소화는 액상혐기소화에 비해 소화조 가온을 위한 에너지가 적게 요구되며, 동일 소화조 용량으로 많은 양의 기질을 처리할 수 있는 장점이 있다 (Luning et al., 2003; Guendouz et al., 2008; Li et al., 2011). 국내 낙농가의 90% 이상은 톱밥 등과 같은 깔짚을 이용하여 젖소를 사육하므로 배출되는 분뇨는 깔짚이 혼합된 수분함량 80% 미만의 고상물 형태가 주를 이룬다 (Ahn et al., 2014). 고상혐기소화는 고형물함량 15% 이상의 기질 처리에 적합한 특성이 있으므로 국내 낙농가에서 발생된 젖소분뇨 처리에는 액상혐기소화에 비해 고상혐기소화가 적합하다. 고상혐기소화는 액상혐기소화와 비교할 때 동일 용량의 소화조에 더 많은 양의 유기물이 투입되는 만큼 혐기소화 기간이 지연돼 경제성이 떨어질 수 있다. 또한 고상혐기소화는 높은 유기물 부하에 따른 휘발성지방산 (VFA; Volatile fatty acids)과 암모니아 집적으로 인해 안정적인 혐기소화를 유도하는데 어려움이 있다. 이러한 문제를 해결하기 위해 시도되고 있는 다양한 방법들 중 접종은 혐기소화 기간을 단축시키고 혐기소화 과정 중 우려되는 VFA 및 암모니아 집적 문제를 저감시켜주는 효과가 있는 것으로 보고된 바 있다 (Mata-Alvarez et al., 2000; Li et al., 2011).
접종은 소화조 내 C/N ratio를 조절하여 영양소 균형을 개선하고 혐기소화 초기 혐기미생물 군집화에 긍정적인 영향을 미치는 등 다양한 장점이 있어 접종과 관련된 여러 연구가 활발히 진행되고 있다 (Eskicioglu and Ghorbani, 2011; Elbeshbishy et al., 2012; Pozdniakova et al., 2012; Córdoba et al., 2016). Elbeshbishy et al. (2012)은 도시생활하수 혐기성 처리시설로부터 회수한 Inocula를 접종해 음식물 쓰레기 혐기소화 공정의 메탄발생 효율을 개선시킨 바 있다. Gu et al. (2014)은 가축분뇨 혐기소화 잔존물의 접종이 볏짚 혐기소화 시 지연기간을 단축하고 메탄 발생량을 증가시켰다고 보고하였다.
접종을 통한 혐기소화 효율 개선을 위한 적정 접종비율 선정과 관련한 연구가 많은 연구자들에 의해 수행된 바 있다. 대부분의 연구에서 적정 접종비율이 제시된 바 있으나 일부 연구결과에 의하면 접종비율을 달리한 실험구 간 혐기소화 효율에 차이가 없었다고 보고된 사례들도 있다. González-Fernández et al. (2009)은 돈분뇨 혐기소화 연구에서 COD/VS 기준으로 혐기성 폐수처리시설에서 회수한 Inocula를 접종비율 1, 2, 3 (Substrate to inoculum ratio) 으로 달리해 혐기소화를 수행한 결과 접종비율에 따른 메탄발생량에 유의미한 차이가 없었다고 보고하기도 하였다.
접종 효과는 기질 및 접종원의 종류에 따라 다르게 나타날 수 있으므로 특정 기질과 접종원을 대상으로 제시된 적정 접종비율을 동일하게 적용해 주는 것은 문제가 있다. Koch et al. (2017)은 기질의 종류에 따라 접종효과는 차이를 보인다고 보고하였으며, Pellera and Gidarakos (2016)는 동일 기질이라고 하더라도 접종원의 종류에 따라 접종 효과가 상이하게 나타난다고 보고한 바 있다. 혐기소화에 사용된 기질과 접종원의 영양소 조성 및 우점하고 있는 미생물 군집의 차이에 의해 접종 효과는 차이를 보인다고 사료된다 (Rastogi et al., 2008; Eskicioglu and Ghorbani, 2011; Elbeshbishy et al., 2012; Gu et al., 2014; De Vrieze et al., 2015; Pellera and Gidarakos, 2016). 따라서 기존 국외의 선행 연구에서 보고한 접종원의 종류와 접종비율을 국내 깔짚 우사에서 발생한 젖소분뇨의 고상혐기소화에 곧바로 적용하는 것에는 어려움이 따를 수 있다.
본 연구에서는 국내 깔짚 우사에서 발생된 젖소분뇨의 고상혐기소화에 활용 가능한 접종원 2개를 선정하여 접종원의 유형 및 각 접종원별 접종비율이 젖소분뇨 고상혐기소화 효율에 미치는 영향을 평가하였다.
Materials and Methods
기질과 접종원
본 연구에서는 충남대학교 동물자원연구센터 젖소분뇨 퇴비사에서 약 4개월간 저장돼 있던 젖소분뇨를 기질로 사용하였다. 접종원은 충남대학교 동물자원연구센터에 설치된 11 ㎥ 용량의 고상혐기소화조에서 젖소분뇨와 착유세정수를 혐기소화한 혐기소화 잔존물 (DMI; Dairy manure inoculum)과 대전광역시 하수처리장의 생활하수 혐기소화 시설에서 수거한 혐기소화 잔존물 (MSI; Municipal sewage inoculum)을 사용하였다. 두 가지 유형의 혐기소화 잔존물을 각각 4,500 rpm으로 15분간 원심분리해 고형물을 추출하였으며, 추출된 고형물은 37°C 항온실에서 Starvation 과정을 거친 후 접종원으로 사용되었다. 본 연구에서 기질로 사용된 젖소분뇨와 전처리 과정을 거친 접종원의 특성은 Table 1과 같다.
Table 1. Characteristics of substrate and inoculum.(mean ± S.D., n=3)
w.b. : wet basis.
d.b. : dry basis.
혐기소화조 운전조건 및 처리구
본 연구는 내부에 PP cylindrical fine-mesh screen (지름 70 mm, 높이 200 mm, 부피 770 mL, 스크린 넓이 1 mm)을 설치해 고상물과 액상물이 분리될 수 있도록 만든 2 L 용량의 Mass cylinder를 혐기소화조로 이용하였다. 각 소화조는 VS 기준으로 접종원에 대한 기질의 접종비율이 0.5, 1, 2, 4가 되도록 기질과 접종원을 혼합한 후 고무마개를 이용해 소화조를 밀폐하였고, 혐기소화 과정 중 발생된 바이오가스는 Tedlar bag을 이용해 포집하였다. 혐기조건 형성을 위해 소화조 부피의 3배에 해당되는 양의 N2로 Flushing한 뒤, 37°C 항온실에서 56일 동안 혐기소화 하였다. 본 연구에서 사용한 각 소화조의 접종원의 종류 및 접종비율은 Table 2와 같다.
Table 2. Substrate to inoculum ratio (VS basis).
| Treatment | Substrate to Inoculum ratio | |
| Municipal sewage inoculum | Dairy manure inoculum | |
| 1 | 0.5 | |
| 2 | 1 | |
| 3 | 2 | |
| 4 | 4 | |
| 5 | 0.5 | |
| 6 | 1 | |
| 7 | 2 | |
| 8 | 4 | |
| Control† | Dairy manure | |
시료분석
수분함량은 105°C 건조기에서 24시간 건조한 후 측정하였으며, 휘발성 고형물은 건조된 시료를 550°C 회화로에서 8시간 회화한 후 측정하였다. 혐기소화 과정 중 소화조 내 액상물의 성분 변화를 평가하기 위해 pH, NH4-N, Alkalinity, VFA를 분석하였다. pH는 pH meter (Orion 4 Strar, Thermo)를 이용해 측정하였으며, NH4-N과 Alkalinity는 Gallery™ automated photometric analyzer (Thermo Fisher Scientific)을 이용해 분석하였다. VFA는 BP20 column (Polyethylene glycol filling, 내경 0.32 mm, 길이 30 m, 필름 두께 1.0 µm)와 FID (Flame Ionization Detector)로 구성된 Gas chromatography (iGC 7200, DS Science, Korea)를 이용해 분석하였다. CH4농도는 Porapak Q column (내경 2 mm, 외경 3 mm, 길이 1.0 M, 그물망 크기 80 - 100)과 TCD (Thermal Conductivity Detector)로 구성된 Gas chromatography (iGC 7200, DS Science, Korea)를 이용해 분석하였다. Gas chromatography의 주입구, 컬럼부, 검출부의 온도는 50°C이며, 25 mL min-1의 유량을 갖는 헬륨가스를 운반기체로 사용하였다.
최종생분해도 및 유기물 분해율
기질의 최종생분해도 (Ultimate Biodegradability; UB)는 혐기소화한 시간 (t) 동안 최초 유기물의 함량 (TVSo)과 소화 후 남아있는 유기물 함량 (TVSe)의 비율을 Graphical statistical method를 이용하여 계산하였다. 혐기소화 과정에서 혐기 미생물이 분해한 유기물의 양은 혐기소화 과정에서 바이오가스 형태로 전환된 양과 같다는 전제하에 아래의 Eq. 1, 2, 3을 이용하여 계산하였다.
| $$BMR(Biomassremoved)=CH_4\;mass+CO_2\;mass$$ | (Eq. 1) |
BMR = biomass removed (g)
Vo = normal state (0°C, 1atm) biogas volume (L)
CH4, CO2=CH4andCO2contents(%) (Eq.3)
Substituting the CO2(%)=100–CH4(%)in(Eq.2)yields(Eq.3)
BMR= Vo ×{1.963–(0.0124×CH4)}
Kinetic modeling (Modified Gompertz)
아래의 Gompertz 방정식을 이용해 실험기간 동안 누적된 CH4 발생량의 Kinetic modeling을 수행하였다.
| $$M\;=\;P\times exp\;\left\{-exp\left[\frac{R_m\times e}P\left(\lambda-t\right)+1\right]\right\}$$ |
M=cumulativeCH4production,production,mLg-VS-1
P=potentialCH4,production,mL g-VS-1
Rm = rate of maximum CH4production, mLg-VS-1 day-1
λ=lag phase period (minimum time to produce biogas) in days
t= cumulative time for CH4production in days
P, λ, Rm은 MS-Excel의 Solver function을 이용해 구하였다.
통계분석
Origin Pro Software (Origin-Lab, version 8.1)를 이용해 Tukey test를 수행하였으며, 누적 바이오가스 생산량과 Gompertz modeling 결과값은 Adjusted regression analysis을 이용해 비교하였다.
Results and Discussion
pH
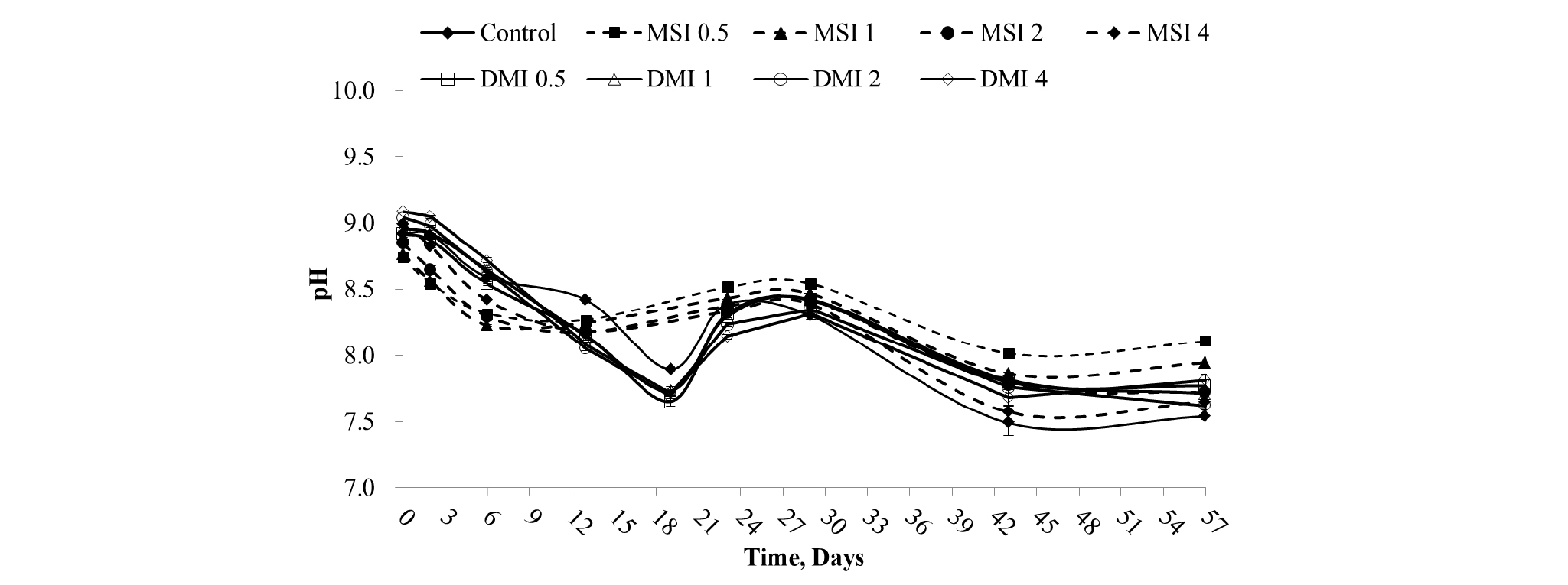
pH는 혐기소화의 안정성을 나타내는 지표인 동시에 혐기소화 안정성에 영향을 미치는 중요한 영향인자이다. Fathya et al. (2014)은 혐기소화 최적의 pH 범위로 6.5 - 7.5를 제시하였으며, Raposo et al. (2012)은 메탄생성균 최적 활성 pH 범위로 7 - 8를 제시하였다. 또한 소화조 내 pH를 조절함으로써 Free Ammonia (FA)로 인하여 발생하는 Ammonia toxicity 문제를 해결하는 것이 가능하기도 하다 (Mao et al., 2015).
Fig. 1은 접종원의 종류 및 접종비율에 따른 pH 변화를 나타내고 있다. MSI가 접종된 실험구는 혐기소화 13일차까지 pH가 감소하였으며, DMI가 접종된 실험구의 경우 실험 19일차까지 pH가 감소하였다. 그 후 두 실험구 모두 혐기소화 29일차까지 pH가 증가하였다. 산 생성 단계와 아세트산 생성 단계 동안 혐기소화조 내 유기물이 미생물에 의해 VFA로 전변돼 pH가 감소하였으며, 이후 VFA가 메탄 생성 단계 동안 메탄생성균에 의해 소모되는 과정에서 pH가 증가한 것으로 추정된다 (Jiang et al., 2013; Fathya et al., 2014). MSI보다 DMI를 접종하였을 때 더욱 많은 VFA가 생산되었으며 이에 따라 pH가 실험 19일차까지 감소한 것으로 판단된다. 모든 실험구는 전반적으로 최적 pH 범위보다 다소 높은 pH 범위 내에서 혐기소화되었다.
NH4-N
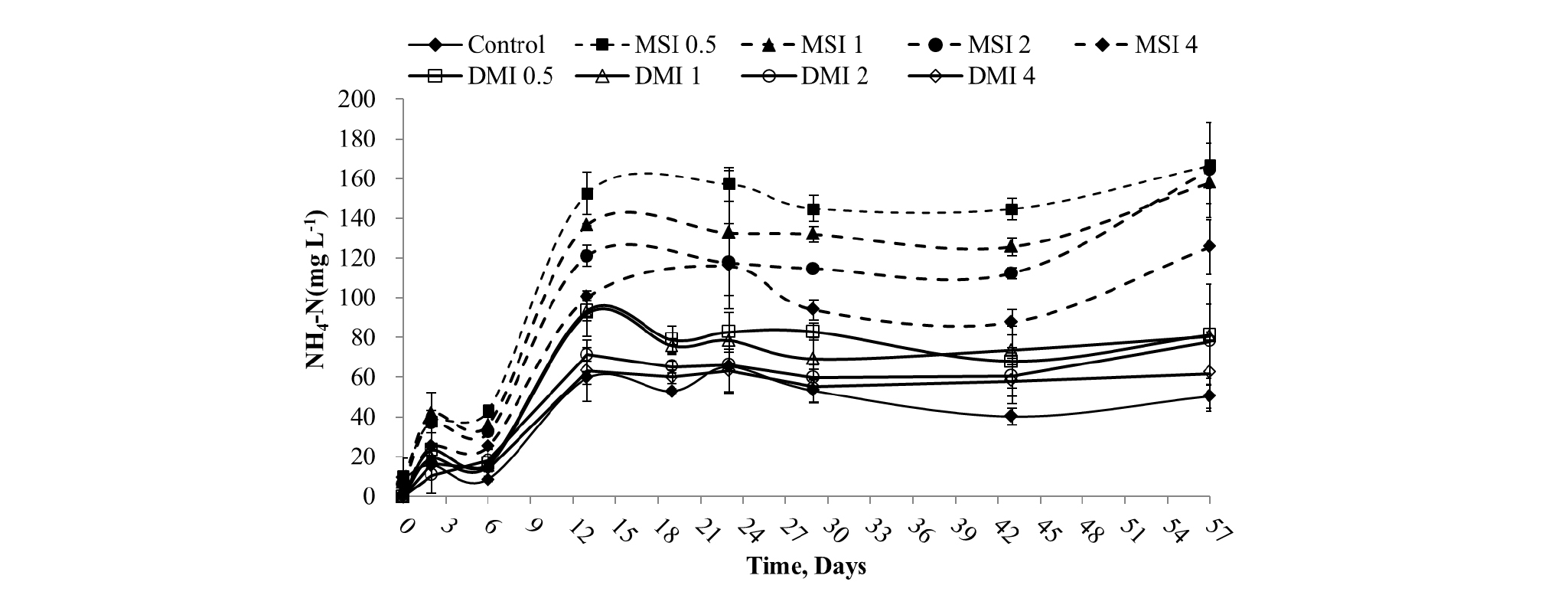
아미노산, 요소, 핵산 등과 같은 유기질소가 혐기소화될 때 발생되는 NH4는 일정 농도 이상에서 혐기소화를 억제한다 (Chen et al., 2008; Chen et al., 2014). McCarty (1964)는 혐기소화조 내 1,500 mg NH4-N L-1의 암모니아가 혐기소화를 저해하였으며 Hobson and Shaw (1976)은 혐기소화를 억제하는 암모니아 수준으로 2,500 mg NH4-N L-1를 보고한 바 있다. 반면 적정 수준의 NH4는 산성화를 억제하며, 혐기미생물 체성장에 필요한 질소 공급원 역할을 하는 등 혐기소화 효율을 증진시키는 기능을 한다는 연구 결과도 있다 (Kayhanian, 1999; Tada et al., 2005; Raposo et al., 2006; Fricke et al., 2007; Zhang et al., 2014; Pellera and Gidarakos, 2016). Steinhaus et al. (2007)은 메탄생성균의 최적 서식 환경으로 250 - 1,100 mg NH4-N L-1를 제시하였으며, Liu et al. (2002)은 혐기소화 적정 암모니아 농도로 200 mg NH4-N L-1를 보고한 바 있다.
접종원의 종류 및 접종비율에 따른 NH4-N (mg L-1)의 변화를 Fig. 2에 나타내었다. 모든 실험구의 NH4-N은 혐기소화 13일차까지 증가하였으며 (42.0 - 152.6 mg L-1), 이후 안정화되는 경향을 보였다. MSI를 접종한 실험구의 최종 NH4-N은 DMI를 접종한 실험구의 NH4-N (61.9 - 81.3 mg L-1)보다 약 2배 높은 125.5 - 166.5 mg L-1 수준을 유지하였으나 혐기소화를 억제할 수 있는 수준에는 미치지 못하였다.
VFA & Alkalinity
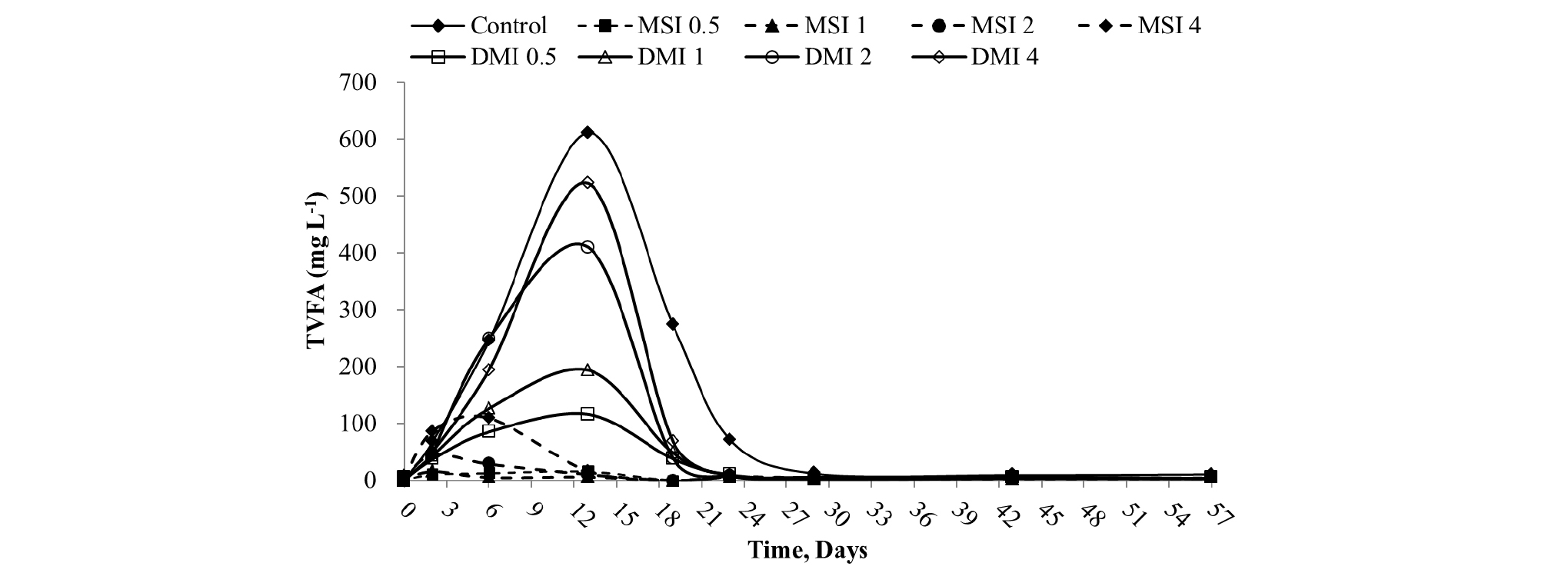
혐기소화의 중간생산물인 VFA는 혐기소화의 안정성을 나타내는 중요한 지표이다 (Lee et al., 2017). 메탄생성균은 VFA로부터 바이오가스를 만들어낸다. 그러나 혐기미생물의 불균형과 과다한 기질의 첨가로 인하여 감소하는 pH에 대한 완충능력을 초과하는 VFA가 축적될 경우 산성화가 촉진되어 안정적인 혐기소화가 유도되지 못할 수 있다 (Forster-Carneiro et al., 2007; Pellera and Gidarakos, 2016). 따라서 소화조 내 적정 수준의 VFA를 유지하는 것은 중요하다.
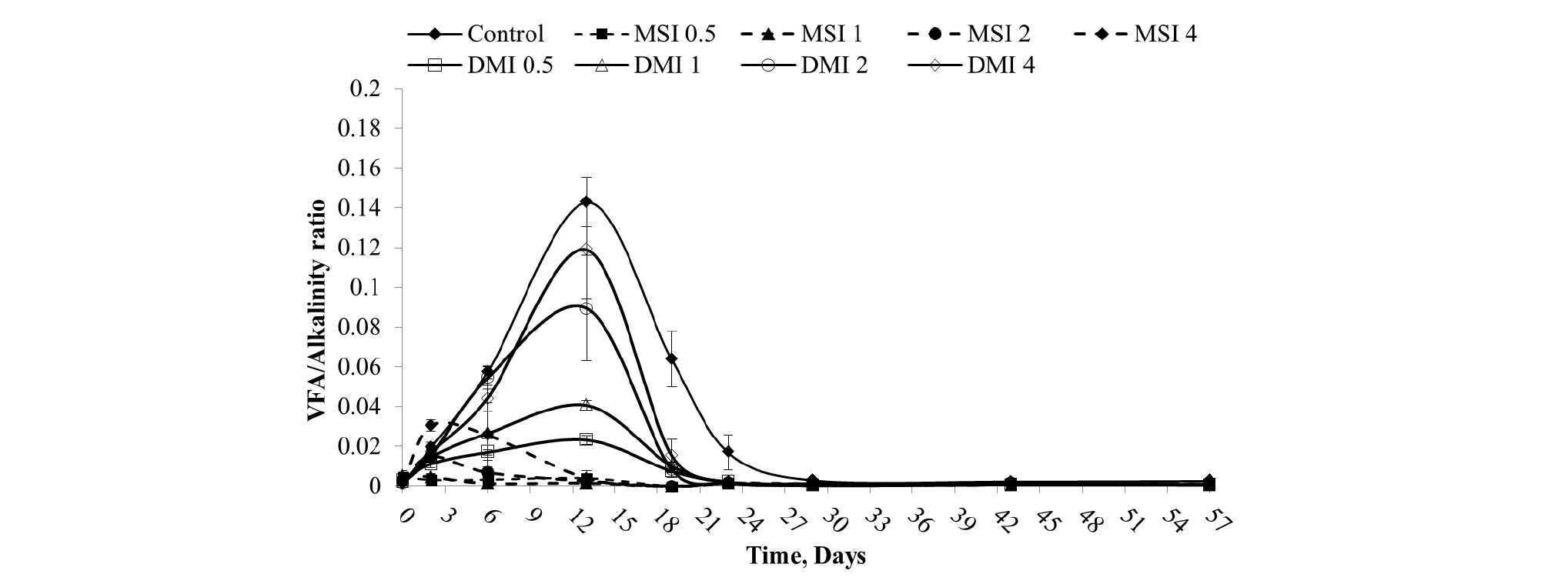
Fig. 3은 접종원의 종류 및 접종비율에 따른 Total Volatile Fatty Acid (TVFA)의 농도 변화를 나타내고 있다. 혐기소화 13일차까지 TVFA (mg L-1)는 증가하다 이 후 감소하는 경향을 나타내었으며, 발생된 정도는 SIR에 비례하였다. 이는 SIR이 증가함에 따라 산 생성 단계에서 혐기미생물이 이용할 수 있는 기질의 양이 많아졌기 때문인 것으로 판단된다. DMI를 접종한 실험구에서 발생된 TVFA 최대치 (116.2 - 522.4 mg L-1)는 MSI를 접종한 실험구의 TVFA 최대치 (5.8 - 16.4 mg L-1)와 비교하여 최대 약 90배 높았으나 모든 실험구는 대조구의 TVFA 최대치 (611.5 mg L-1)에 비해 낮은 수준을 보여주었다.
Alkalinity는 산을 중화시키는 능력을 의미하며, 발생된 VFA에 대한 적절한 수준의 Alkalinity는 안정적인 혐기소화 유도를 위해 필요하다 (Ağdağ and Sponza, 2005). 일반적으로 VFA/Alkalinity 비율이 0.4 이하일 경우 혐기소화는 급변하는 pH에 대하여 완충능력을 가질 수 있지만, 0.4를 초과할 경우 불안정성이 높아지며 0.8을 상회할 때 혐기소화는 억제될 수 있다 (Operations et al., 1976; Switzenbaum et al., 1990; Khanal, 2011; Kameswari et al., 2012; Karthikeyan et al., 2013). 따라서 VFA/Alkalinity 비율은 혐기소화 공정의 안정성을 나타내는 척도로 활용될 수 있다 (Fathya et al., 2014).
Fig. 4는 접종원의 종류 및 접종비율에 따른 각 실험구의 VFA/Alkalinity 비율 변화를 나타내고 있다. 본 연구 기간 동안 모든 실험구의 VFA/Alkalinity 비율은 0.4 이하였다. 따라서 모든 실험구는 급변하는 pH에 대한 안정성을 가졌음을 알 수 있다.
유기물 분해율
본 연구 기간 동안 혐기소화조 내 분해된 유기물 양과 발생된 바이오가스 양을 토대로 각 실험구의 혐기소화 효율을 평가하였다. 가축분뇨에 함유되어 있는 유기물은 생분해 가능한 유기물 (BVS; Biodegradable volatile solids)과 그렇지 못한 유기물로 나뉘며 BVS만이 최종적으로 CH4와 CO2로 전환될 수 있다. 혐기소화 과정에서 분해된 유기물의 양은 바이오가스 형태로 전환된 양과 동일하다고 가정해도 이론적으로 큰 문제가 없다고 본다 (Lee et al., 2017). Table 3은 제거된 유기물의 양 (BMR), 기질의 최종생분해도 (UB), 총유기물 제거율 (TVS removal), 생분해 가능한 유기물 제거율 (BVS removal)등을 보여주고 있다.
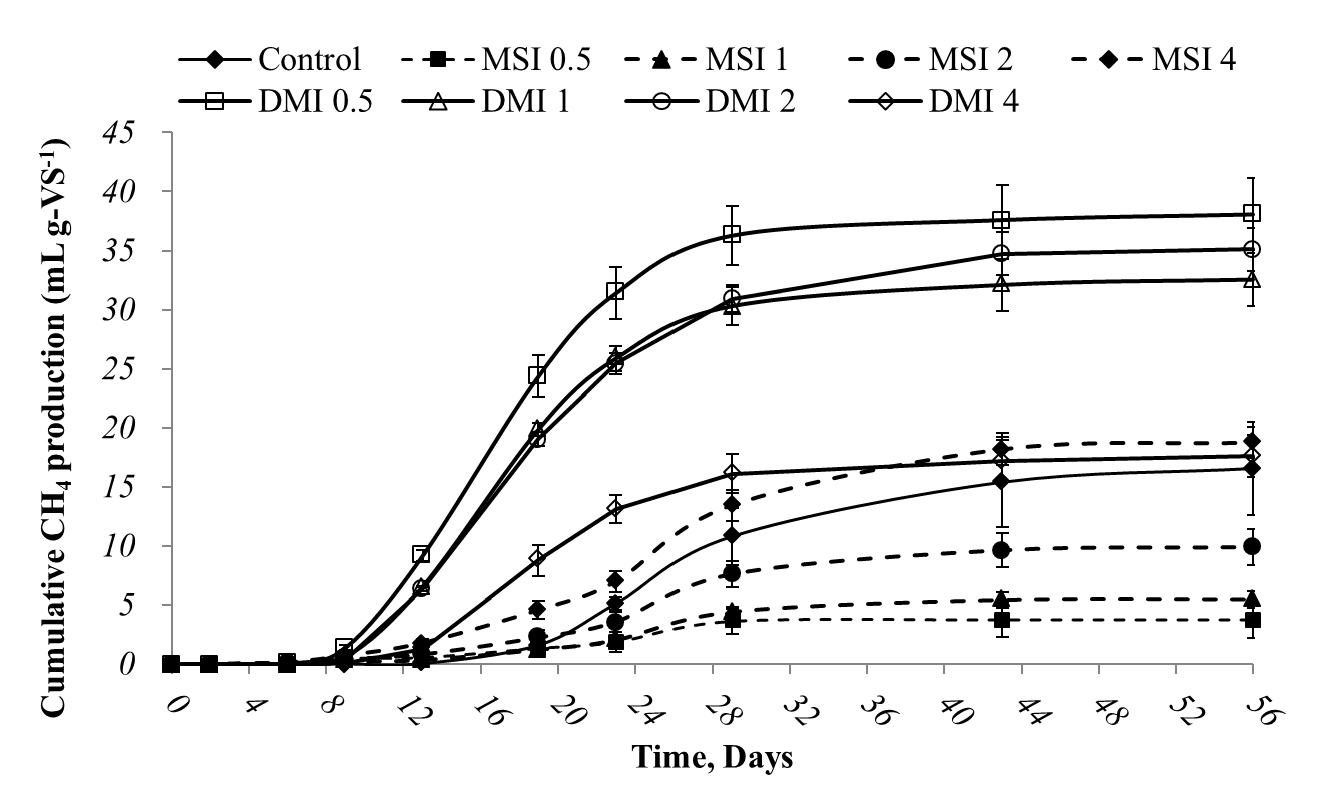
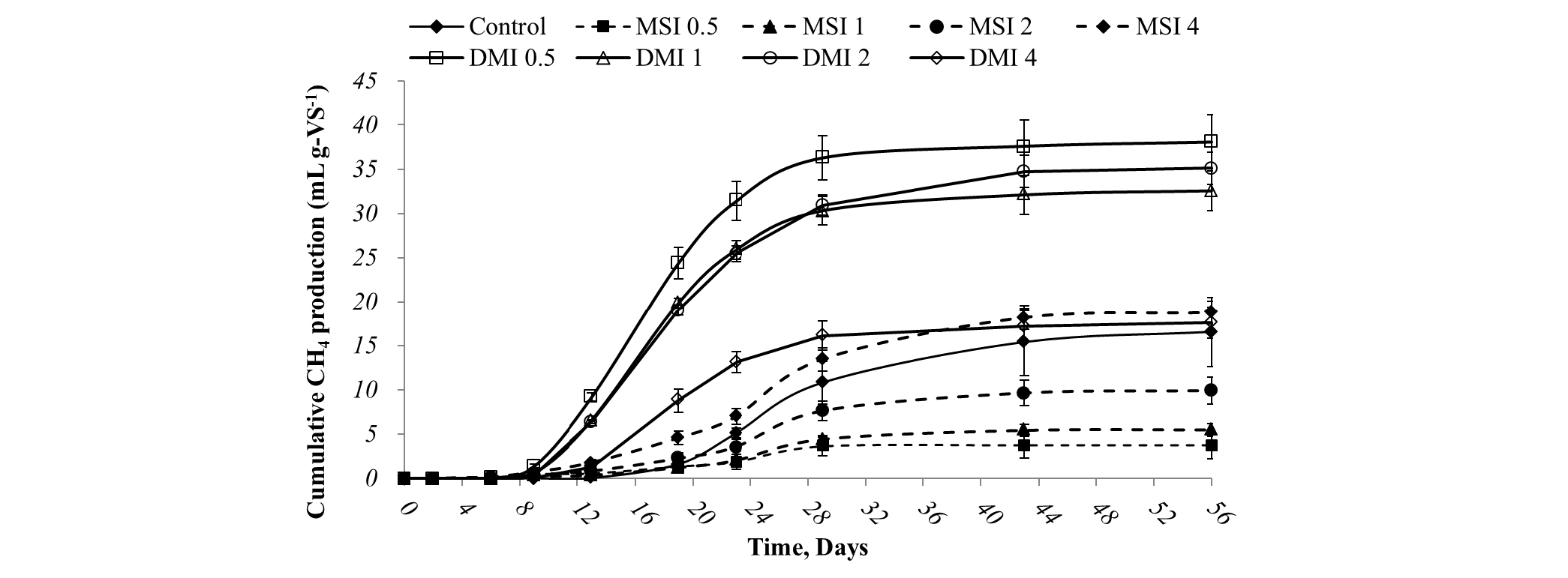
DMI 0.5, 1, 2의 UB (18.9, 15.6, 15.6%)와 BVS removal (82.1, 66.9, 66.1%)는 MSI가 접종된 실험구보다 높은 효율을 보여주었다. 따라서 Fig. 6에 나타낸 바와 같이 DMI가 접종된 실험구는 MSI가 접종된 실험구보다 뛰어난 Cumulative CH4 production을 나타내었다. 특히, DMI 0.5의 경우 모든 실험 구 중 가장 높은 UB (18.9%) 및 BVS removal (82.1%)과 가장 우수한 Cumulative CH4 production (38.1 mL g-VS-1)을 보였다.
Table 3. Biomass removed, ultimate biodegradability and volatile solids removal of test units with different inocula. (Mean ± S.D.)
바이오가스발생 효율 (Kinetic modeling)
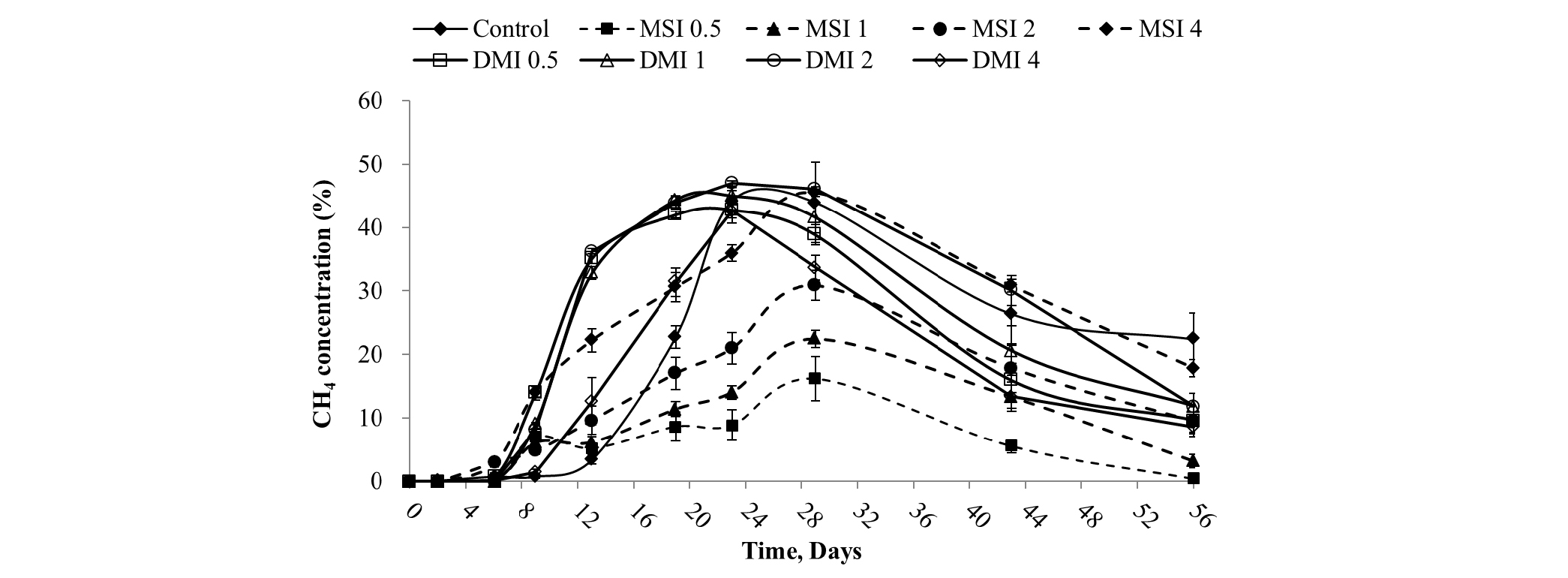
Fig. 5와 6은 접종원의 종류 및 접종비율에 따른 CH4 농도 (%)와 Cumulative CH4 production을 나타내고 있다. MSI가 접종된 실험구는 SIR이 증가함에 따라 CH4 농도 (%)와 Cumulative CH4 production도 함께 증가하는 경향을 보였다. 이는 SIR이 증가함으로써 소화조 내 메탄생성균이 이용 가능한 기질의 양이 많아져 나타난 결과로 추정된다 (Pellera and Gidarakos, 2016). 대조구의 Cumulative CH4 production (16.5 mL g-VS-1)과 비교할 때 MSI 0.5, 1, 2는 적은 Cumulative CH4 production을 나타내었다. DMI를 접종한 실험구는 DMI 4를 제외한 전 구간에서 대조구 및 MSI가 접종된 실험구와 비교하여 높은 CH4 농도 (%)와 Cumulative CH4 production을 나타내었다.
국내 톱밥깔짚우사에서 발생된 분뇨의 처리 특성상 젖소분뇨에는 NDF 및 Lignin이 다량 함유되어 있다 (Table 1). NDF는 생분해도가 낮은 유기물로 분류되며, Lignin은 Hemicellulose 및 Cellulose와 결합 후 Lignocellulose를 형성하여 혐기미생물의 기질 이용성을 떨어트릴 수 있다 (Sawatdeenarunat et al., 2015). 반추 동물인 젖소의 소화관 내에는 메탄생성균 뿐만 아니라 박테리아와 곰팡이, 프로토조아와 같이 난분해성 물질인 Lignocellulose의 분해를 돕는 다양한 미생물이 존재한다 (Priya et al., 2008; Bayané et al., 2011). Ozbayram et al. (2018)은 반추위액과 우분 내 미생물 조성을 비교한 연구에서 섬유소분해 미생물 과에 속하는 Ruminococcaceae (31%)와 Bacteroidaceae (13%)가 우분 내 우점하고 있음을 확인한 바 있다. Xu et al. (2013)은 옥수수 대를 혐기소화한 연구에서 섬유소분해 미생물 군집 수의 차이로 인하여 도시생활하수 슬러지 Inocula가 접종된 소화조보다 젖소분뇨 혐기소화 Inocula가 접종된 소화조에서 보다 많은 메탄이 발생하였음을 보고한 바 있다. 따라서 반추동물의 장 내 미생물이 다량 함유되어 있는 DMI가 접종된 실험구의 경우 MSI가 접종된 실험구에 비하여 우수한 Cumulative CH4 Production을 보여주었다고 볼 수 있다.
그러나 국내 톱밥깔짚우사에서 발생된 젖소분뇨의 높은 난분해성 유기물의 함량으로 인하여 가장 우수한 Cumulative CH4 Production을 나타낸 DMI 0.5 조차 젖소분뇨를 혐기소화시킨 Amon et al. (2007)의 보고 (125.5 - 166.3 mL g-VS-1)와 비교할 때 낮은 측정치 (38.1 mL g-VS-1)을 보였으며, Frigon et al. (2010)이 보고한 기질 내 원소 조성에 기반한 이론적 메탄발생 잠재력 기대값 (357 mL CH4 g-VS-1)의 10% 수준에 불과하였다.
또한 본 연구에서 혐기소화의 기질로 이용한 젖소분뇨는 약 6개월간 우방과 퇴비사에서 저장되어 있었다. 젖소분뇨를 장기간 보관할 경우 분뇨 내 유기물의 조성 및 함량이 변화될 수 있다 (McCalla et al., 1970). 질소의 경우 저장 기간 동안 침출수, 암모니아의 휘산 등에 의해 약 10 - 40% 손실이 발생될 수 있으며 (Petersen et al., 1998), 탄소의 경우 약 46 - 62%의 손실이 발생될 수 있다 (Eghball et al., 1997; Petersen et al., 1998). 따라서 본 연구의 저조한 Cumulative CH4 Production은 젖소분뇨 내 혼합되어 있는 높은 난분해성 유기물 함량과 젖소분뇨의 여름철 장기간 보관으로 인한 영양소 조성의 변화에서 기인된 것으로 판단된다.
접종원의 종류 및 접종비율에 따른 Gompertz modeling 결과를 Table 4, 5, 6에 나타내었다. MSI 0.5와 1의 메탄발생 잠재력 (P: 3.9, 5.6 mL g-VS-1)은 대조구 (P: 20.6 mL g-VS-1)와 비교하여 낮은 결과를 나타내었다. 지연기간 (λ)은 MSI 0.5 (11.4 day)를 제외한 MSI 1, 2, 4 (16.3, 15.8, 14.1day)와 대조구 (19 day) 간 유의미한 차이가 없었으며 잠재적 메탄발생량의 95%가 되는 시점 (T95)은 MSI 전 구간에서 대조구와 유의미한 차이가 없었다. 소화조 부피당 잠재적 메탄발생량 (V/V in HRT)은 대조구가 모든 MSI 실험구와 비교하여 높았다 (V/V in HRT 30 days: 0.6). DMI 4를 제외한 DMI 0.5, 1, 2는 MSI가 접종된 실험구 및 대조구와 비교할 때 메탄발생 잠재력 (P), 지연 기간 (λ), 잠재적 메탄발생량의 95%가 되는 시점 (T95)에서 높은 효율을 보여주었으며, 특히 DMI 2는 소화조 부피 당 잠재적 메탄발생량 (V/V in HRT)에서 가장 우수한 발생량 (V/V in HRT 30 days: 0.9)을 나타내었다. 이러한 결과를 토대로 DMI 2의 혐기소화 효율이 본 연구에서 가장 우수하였다고 판단된다.
Table 4. Gompertz model values of anaerobic digesters inoculated with municipal sewage inoculum (MSI). (Mean ± S.D.)
‡Volume of methane produced/Volume of digester.
a~d means with different superscripts in the same row of each group are significantly different (p < 0.05).
Table 5. Gompertz model values of anaerobic digesters inoculated with dairy manure inoculum (DMI). (Mean ± S.D.)
‡Volume of methane produced/Volume of digester.a~c means with different superscripts in the same row of each group are significantly different (p < 0.05).
Table 6. Gompertz model values of each anaerobic digesters. (Mean ± S.D.)
‡Volume of methane produced/Volume of digester.
a~f means with different superscripts in the same row of each group are significantly different (p < 0.05).
Conclusions
깔짚우사에서 수거한 젖소분뇨를 고상혐기소화시킨 결과, Dairy manure inoculum이 접종된 실험구가 Municipal sewage inoculum이 접종된 실험구보다 우수한 메탄 발생 효율을 보여주었으며 Dairy manure inoculum이 접종된 실험구 중 접종원에 대한 기질의 혼합 비율 2에서 가장 우수한 소화조 부피당 메탄발생 잠재력을 나타내었다. 그러나 젖소분뇨에 포함되어 있는 다량의 난분해성 물질뿐만 아니라 젖소분뇨의 장기간 저장으로 인한 영양소 손실이 발생하여 Cumulative CH4 Production은 최대 38.1 mL g-VS-1에 불과하였다. 따라서 Dairy manure inoculum을 접종하는 것만으로는 국내 깔짚우사에서 발생된 젖소분뇨를 충분히 혐기소화시키는 데에는 어려움이 있다고 사료된다. 그러므로 메탄발생 효율을 개선하기 위해 영양소 손실이 덜 발생된 신선한 젖소분뇨나 메탄발생 잠재력이 높은 농축부산물을 혐기소화의 기질로 혼합 이용해야 할 뿐만 아니라 접종비율을 보다 세분화하여 최적의 접종비율을 파악하는 추가적인 연구가 수행될 필요가 있다.