Introduction
Materials and Methods
Results and Discussion
Conclusions
Introduction
우리나라 고구마 재배면적은 2010년 19,200 ha에서 2019년 21,941 ha로 14% 증가하였고 조기재배를 도입함으로 2010년 29만 8,930톤에서 2018년 30만 5,304톤으로 연차별 생산변동은 작황에 따라 큰 변동 폭을 보이고 있다 (KOSIS, 2020). 그럼에도 불구하고 2018년부터 농림축산식품부에서 논 타작물 재배 지원 사업을 추진함으로 고구마 논 재배 면적은 지속적으로 증대될 것으로 기대된다 (MAFRA, 2018). 따라서 고구마는 동일 품종이라도 재배지역, 토양 특성에 따라 수량 및 품질 차이가 있으므로 논 재배에 적합한 품종선발이 필요하다. 국내 농업관련 연구기관에서 논 재배용으로 검토하고 있는 고구마 품종은 분질품종으로 대유미, 진홍미, 고건미 등이 있으며 중간질 및 유색 고구마는 풍원미와 신자미 등이 있다 (Choi et al., 2019; Lee et al., 2019; Moon et al., 2019; Nam et al., 2019). 온대 및 열대 지역에서 재배되는 고구마는 토양의 열악한 조건에서도 식량으로서 생산성이 뛰어나며 비료나 농약 요구량이 적고 태풍, 가뭄 및 강우와 같은 단기간의 환경 스트레스에 잘 견디는 환경 친화적인 작물이다 (Kozai et al., 1996; Ahn et al., 1998). 그러나 식물은 토양의 영향을 많이 받는데 고구마의 경우 괴경이 성장하는 시기에 발생하는 토양 건조는 수량에 크게 영향을 준다 (Bourke, 1989). 토양 수분함량은 고구마 생육과 밀접한 관계가 있으며 관개수 양이 적정수준을 초과하면 수량이 감소하는 경향이 있지만 (Thompson et al., 1992), 대체적으로 카사바 보다 배수불량 조건에서도 잘 견디는 특징이 있다 (Ghuman and Lal, 1983). 고구마 수량은 수분 부족에 크게 영향을 받아 모래 토양은 표면 아래 25 cm (Pardales and Yamauchi, 2003), 정식 101일 후 양질사토에서는 30 - 50 cm 깊이의 지하수위가 적당하며 (Siqinbatu et al., 2013), 토양 유형과 관개 횟수에 영향을 받는다 (Anderson, 1941). 그리고 토양 수분함량이 적어 건조해지면 고구마 덩굴쪼김병 발생이 많아지게 된다 (Harter and Whitney, 1927; Clark and Moyer, 1988). 일반적으로 유기물과 수분 함량이 낮은 사질 계통의 토양에서 가뭄과 지온이 높아질 때 발병이 심하며 토양 경사가 7%이상, 유효토심이 50 cm 이하, 수분과 양분 유실이 심할 경우 고구마 수량이 75%정도 감소했다는 보고가 있다 (Jung et al., 2001). 사질토양에서 고구마 생육에 필요한 최적 수분함량은 포장용수량의 80% 수준이다 (Belehu and Hammes, 2004). 고구마 이식 후 25일에서 30일 동안 괴근분화기는 수분 부족에 가장 민감하게 반응하며 (Nair and Nair, 1995; Ravi and Indira, 1996), 수분이 부족할 경우 부정근의 목질화를 유발한다 (Ravi and Indira, 1996). 고구마 재배지 토양 입단과 수분관리를 위한 연구를 보면 바이오차를 10a당 4톤 사용한 결과 수량이 54% 증대되었다 (Liu et al., 2014). Chen et al. (2014)은 토양 미생물체량은 수분함량 때문에 논토양이 밭토양보다 영향을 덜 받는다고 하였다. 이와같이 고구마에 대한 토양 수분관리를 합리적으로 수행하고 쌀 생산 조정 정책으로 최근 밭토양 보다 유리한 논토양 재배 연구가 진행되고 있다 (Lestari et al., 2019). 토양 미생물 다양성을 평가하고 유지하는 것은 친환경농업을 추진하기 위한 기본적인 요건이며 최근 미생물 군집 분석을 통한 토양 환경 개선 연구가 활발히 진행되고 있다 (Igalavithana et al., 2017; Moon et al., 2019Yi et al., 2020). 미생물 군집을 분석하는 방법으로 미생물의 세포벽 지방산을 분석하는 fatty acid methyl ester (FAME)와 phospholipid fatty acid (PLFA) 분석법이 있으며 (Schutter and Dick, 2000; Morris et al., 2008), DNA 증폭을 기반으로 하는 차세대 염기서열 분석법인 파이로시컨싱 등이 있다 (Ronaghi et al., 1996). 파이로시컨싱은 분석 정확도는 높지만 고가의 비용이 발생되기 때문에 토양 시료가 많을 경우 저렴하고 빠르게 분석할 수 있는 FAME 방법을 많이 사용하고 있다 (Cho et al., 2019; Yang et al., 2019; Yi et al., 2020). 고구마 재배지에 대한 미생물 군집은 시비수준이 증가할수록 곰팡이 군집이 많아지며 (Moon et al., 2019), 인산칼륨을 엽면시비할 경우 5%까지 농도가 높아질수록 곰팡이 군집은 적어졌다는 보고가 있다 (Moon et al., 2019). 그러나 논토양과 밭토양에서 고구마를 재배할 경우 토양 미생물 군집을 비교 평가한 연구는 전무한 실정이다.
따라서 본 연구는 특성이 다른 고구마 품종인 진홍미와 신자미를 논토양과 밭토양에 재배하고 생육과 수량, 토양 화학성과 FAME 분석법에 의한 미생물 군집 차이를 검토하였다.
Materials and Methods
시험 토양 조건 고구마에 대한 토양 유형과 품종에 따른 생육반응을 검토하기 위해 이현미사질양토의 밭토양과 논토양에서 시험을 수행하였다. 시험 토양은 모래 21%, 미사 57%, 점토 22%의 미사질양토로서 배수는 양호한 토양이었다. 시험에 사용된 토양 화학성은 Table 1과 같이 논토양 화학성은 pH 6.7, EC 0.49 dS m-1, 유기물 21 g kg-1, 유효인산 90 mg kg-1, 치환성 칼륨 0.56 cmolc kg-1, 치환성 칼슘 8.1 cmolc kg-1, 치환성 마그네슘 2.2 cmolc kg-1 이었다. 논토양 양분관리는 비료사용처방서에 따라 ha 기준에 요소 120 kg, 용성인비 1,070 kg 및 황산칼리 380 kg을 전량 기비로 시비하였다. 시험전 밭토양 화학성은 pH 6.9, EC 0.46 dS m-1, 유기물 20 g kg-1, 유효인산 240 mg kg-1, 치환성 칼륨 0.18 cmolc kg-1, 치환성 칼슘 10.2 cmolc kg-1, 치환성 마그네슘 2.2 cmolc kg-1 이었다. 밭토양 양분관리는 비료사용처방서에 따라 ha 기준에 요소 120 kg, 용성인비 860 kg 및 황산칼리 470 kg을 전량 기비로 시비하였다.
Table 1.
Chemical properties of soils used in the experiment.
|
Soil type
|
pH
|
EC
|
OM
|
Avail. P2O5 |
K
|
Ca
|
Mg
|
|
(1:5)
|
dS m-1 |
g kg-1 |
mg kg-1 |
------------- Exch. Cat. cmolc kg-1 -------------
|
|
Paddy
|
6.7
|
0.49
|
21
|
90
|
0.56
|
8.1
|
2.2
|
|
Upland
|
6.9
|
0.46
|
20
|
240
|
0.18
|
10.2
|
2.2
|
재배 조건 및 수량조사 시험기간 기상조건은 Fig. 1과 같이 평균 기온은 20.1°C였으며 합산 강우량은 1,309 mm였고 관개방법은 자연강우에 의존하였다. 시험에 사용한 품종은 농업관련 연구기관에서 논 재배에 적합한 고구마 품종으로 제시한 (Lee et al., 2019; Moon et al., 2019; Nam et al., 2019) 식용 및 전분용 분질 고구마로 진홍미 (Ahn et al., 2000)와 가공용 유색 고구마로 신자미 (Ahn et al., 2002)를 선택하였다. 정식 시기는 2018년 5월 28일에 휴간 75 cm, 주간 20 cm 간격으로 처리당 80주, 3반복으로 하였고 수확은 삽식 후 120일에 하였다. 고구마 생육은 농업과학기술 연구조사분석기준 (RDA, 2012)에 따라 수확 직전에 주만장, 경엽중 등 지상부 생육과 수확 후 상품무게, 주당 상품수 등 수량 특성을 조사하였다. 그리고 고구마 전분함량은 생체 100 g 당 건조전분 무게를 측정하고 건물률에 대한 백분율로 분석하였다 (Choi et al., 2017).
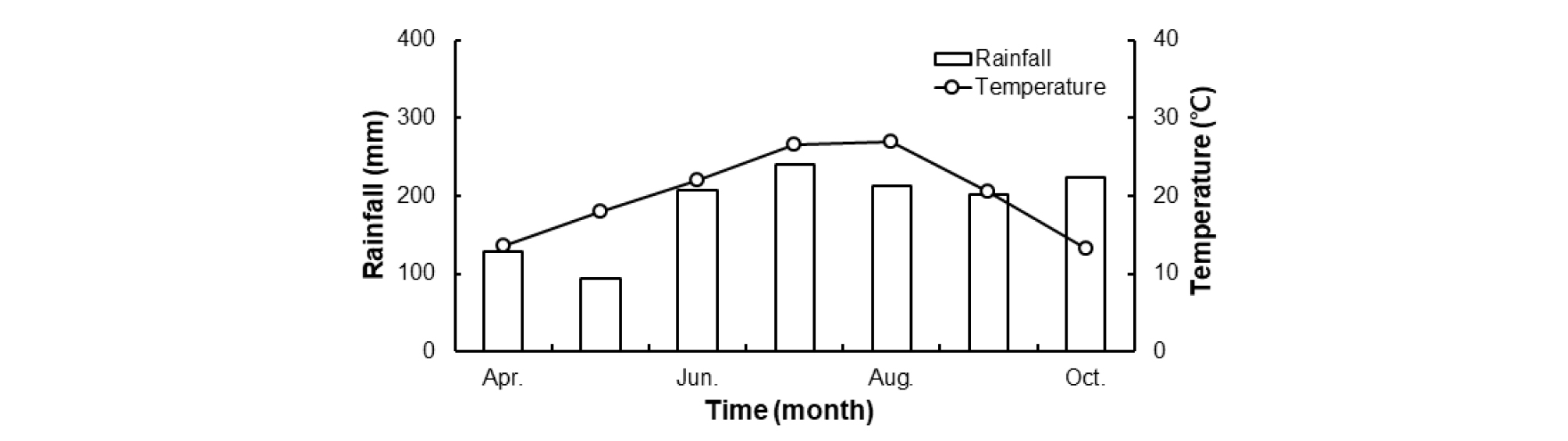
Fig. 1.
The average temperature and precipitation in experimental sites.
토양 화학성분 및 미생물 분석 분석을 위한 토양 시료는 처리구 마다 1 cm정도 걷어내고 0 - 15 cm 깊이에서 3반복으로 채취하였다. 화학 분석용 토양은 그늘진 실험실에서 7일간 건조하여 고무망치로 입자를 분쇄한 후 2 mm 체를 통과한 것을 사용하여 분석하였다 (NAS, 2010). 토양 pH와 EC는 토양 10 g에 50 mL 증류수를 가하여 1:5 비율로 희석하고 비이커를 가끔씩 저어주면서 1시간 정치한 후 pH meter (Orion 520A pH meter, Orion Research Inc., Boston, USA)와 EC meter (Orion 3STAR EC meter, Orion Research Inc., Boston, USA)로 분석하였다. 유기물은 Tyurin법, 유효인산은 Lancaster법으로 비색계 (UV-1650PC, Shimadzu Co., Kyoto, Japan)를 사용하여 분석하였다. 치환성 칼륨, 칼슘, 및 마그네슘 등의 양이온은 1 M NH4OAc로 추출하여 ICP (AAnalyst 300, Perkin-Elmer, Norwalk, USA)로 분석하였다.
수확기 토양의 미생물 함량과 군집은 습토를 사용하여 –20°C에 2일간 보관하여 동결건조 한 후 Schutter and Dick (2000)의 방법으로 미생물 세포벽 지방산인 fatty acid methyl ester (FAME)를 분석하였다 (Kim et al., 2014; Moon et al., 2016; Igalavithana et al., 2017; Cho et al., 2019; Moon et al., 2019). 지방산 추출은 토양 3 g에 0.2 M KOH 15 mL를 넣고 37°C에서 1시간 항온 후 1.0 M acetic acid 3 mL를 가하여 중성화 시킨다. 여기에 hexane 10 mL 가하여 60초간 흔든 후 2,000 × g에서 20분간 원심분리 후 핵산층을 모아 질소가스로 40분간 증발시키고 30 µL의 internal standard 19:0과 170 µL의 1:1 hexane:methyl-tert butyl ether로 녹여 GC로 분석하였다. 미생물 함량과 군집 분석에 사용한 기기는 GC Agilent 6890N (Agilent Technologies, USA)과 HP-ULTRA 2 capillary column (25 m × 0.2 mm × 0.33 µm film thickness, Agilent Technologies, USA)이었으며 Internal standard 19:0을 이용하여 상대적인 지방산 함량과 비율을 계산하였다 (Hamel et al., 2006; Moon et al., 2019).
통계분석 토양유형과 품종에 따른 통계분석은 SAS 프로그램 9.4 버전 (2019)을 사용하여 고구마 수량과 생육상황, 토양 화학성과 미생물 군집 등은 two-way ANOVA 분석으로 F-test를 수행하였고 고구마 수량과 미생물 군집은 주성분 분석을 통하여 토양 유형과 품종에 따른 차이를 검토하였다.
Results and Discussion
고구마 생육 및 수량 진홍미는 경남에서 분질 고구마로 20% 정도 재배되는 품종이며, 신자미는 자색 고구마로서 가공용으로 많이 사용하고 있다 (Ahn et al., 2000; Ahn et al., 2002). 수확기 논토양과 밭토양에서 고구마 생육과 수량은 Table 2와 같다. 토양 유형별 고구마 상저중은 논토양에서 진홍미가 165 g, 신자미가 164 g으로 밭토양 진홍미 127 g, 신자미 134 g 보다 무거웠으나 (p < 0.01) 품종 간에 차이는 없었다. 고구마 수량도 논토양에서 진홍미가 37.3 Mg ha-1, 신자미가 46.1 Mg ha-1으로 밭토양의 진홍미 27.8 Mg ha-1, 신자미 37.3 Mg ha-1 보다 진홍미는 34%, 신자미는 24% 증대하여 평균 28% 많았다 (p < 0.001). 이러한 결과는 Lestari et al. (2019)이 보고한 바와 같이 논토양은 밭토양에 비해 고구마 수량이 2배에서 4배 높다고 보고한 결과와 일치하였다. Gajanayake and Reddy (2016)는 고구마 생육 중기와 후기에 토양 수분함량이 부족해지면 괴경이 직선적으로 감소한다고 하였다. 또한, Bourke (1989)도 고구마 괴경이 성장하는 시기에 발생하는 토양 건조는 수량에 크게 영향을 준다고 하였다. 본 연구에서도 Table 3과 같이 논토양의 수분함량은 평균 28.5%로서 밭토양 평균 21.8% 보다 높게 나타나 (p < 0.001) 고구마 괴경 형성에 영향을 주고 수량 차이를 나타낸 것으로 판단되었다. 그러나 토양 유형에 따른 고구마의 주만장, 주당 마디수, 경엽중, 상저수, 전분함량 등은 유의적인 차이가 없었다. 품종에 따라 신자미는 진홍미에 비해 주당 상저수가 논토양에서는 1.0개, 밭토양에서는 0.9개 많았으며 (p < 0.01). 수량도 논토양에서 24%, 밭토양에서 34% 증대되었다 (p < 0.001). 반대로 진홍미는 주당 마디수와 전분함량이 신자미에 비해 유의적으로 많았다 (p < 0.01). 이러한 결과는 주당 마디수는 진홍미가 신자미 보다 주당 7.9개 많고 품종 고유 특성으로 분질품종인 진홍미가 점질품종인 신자미에 비해 전분함량이 높다고 보고한 Choi et al. (2017)의 결과와 일치하였다.
Table 2.
Effect of different soil types on the growth and yield of sweet potato.
|
Soil type
|
Variety
|
Vine lengh
|
Node number
|
Plant weight
|
Marketable
root number
|
Marketable
root weight
|
Yield
|
Starch
value
|
| |
cm
|
no. plant-1 |
Mg ha-1 |
no. plant-1 |
g
|
Mg ha-1 |
%
|
|
Paddy
|
Jinhongmi
|
270
|
59
|
43.4
|
3.5
|
165
|
37.3
|
24.5
|
|
Sinjami
|
196
|
53
|
33.0
|
4.5
|
164
|
46.1
|
22.0
|
|
Upland
|
Jinhongmi
|
244
|
63
|
38.2
|
3.3
|
127
|
27.8
|
27.0
|
|
Sinjami
|
246
|
55
|
39.1
|
4.2
|
134
|
37.3
|
21.7
|
|
Significance† |
Type
|
NS
|
NS
|
NS
|
NS
|
**
|
***
|
NS
|
|
Variety
|
*
|
**
|
*
|
**
|
NS
|
***
|
**
|
|
Type×Variety
|
*
|
NS
|
*
|
NS
|
NS
|
NS
|
NS
|
†Significant effects were obtained from two-way analysis of variance: NS, not significant; *, significant at
p < 0.05; **, significant at
p < 0.01; ***, significant at
p < 0.001.
토양 화학성 변화 토양 유형에 따른 수확기 토양 화학성분은 Table 3과 같다. 밭토양은 논토양에 비해 pH는 0.5에서 0.2 높았고 (p < 0.01) 유효인산 함량 (p < 0.001), 치환성 칼륨 (p < 0.01), 칼슘 (p < 0.05), 마그네슘 (p < 0.001) 함량이 많은 것으로 나타났으나 염류농도 및 유기물 함량은 차이가 없었다. 밭토양의 pH, 유효인산, 치환성 칼슘 함량이 논토양 보다 높게 나타난 것은 시험전 토양 화학성분과 시비처방으로 투입된 비료량 차이 때문인 것으로 판단되었다. 또한, 논토양에서 치환성 칼륨과 마그네슘 함량이 밭토양 보다 낮게 나타난 것은 Atto (1946)의 보고와 같이 칼륨과 마그네슘 고정은 수분이 감소할수록 많았기 때문인 것으로 생각된다. 또한, Osaki et al. (1995)의 보고와 같이 칼륨이 고구마 수량에 가장 크게 영향을 미치므로 양분 흡수에 의한 감소로 판단된다. 그리고 품종에 따른 토양 pH는 논토양에서 신자미가 진홍미에 비해 0.3 높았으나 염류농도, 유기물, 유효인산, 치환성 양이온 함량 등은 차이가 없었다.
Table 3.
Soil chemical properties of different soil types at harvest stage of sweet potato.
|
Soil type
|
Variety
|
pH
|
EC
|
OM
|
Avail. P2O5 |
K
|
Ca
|
Mg
|
Soil moisture
|
| |
(1:5)
|
dS m-1 |
g kg-1 |
mg kg-1 |
----- Ex. Cat. cmolc kg-1 -----
|
%
|
|
Paddy
|
Jinhongmi
|
6.5
|
0.31
|
20
|
151
|
0.13
|
7.7
|
2.1
|
28.6
|
|
Sinjami
|
6.8
|
0.28
|
19
|
124
|
0.14
|
8.2
|
2.2
|
28.4
|
|
Upland
|
Jinhongmi
|
7.0
|
0.22
|
16
|
254
|
0.21
|
8.5
|
2.7
|
21.8
|
|
Sinjami
|
7.0
|
0.23
|
20
|
273
|
0.29
|
9.1
|
2.8
|
21.8
|
|
Significance† |
Type
|
**
|
NS
|
NS
|
***
|
**
|
*
|
***
|
***
|
|
Variety
|
*
|
NS
|
NS
|
NS
|
NS
|
NS
|
NS
|
NS
|
|
Type×Variety
|
NS
|
NS
|
*
|
NS
|
NS
|
NS
|
NS
|
NS
|
†Significant effects were obtained from two-way analysis of variance: NS, not significant; *, significant at
p < 0.05; **, significant at
p < 0.01; ***, significant at
p < 0.001.
토양 미생물 함량 및 군집 수확기 토양 유형에 따른 미생물 함량은 Table 4와 같다. 미생물체량을 나타내는 총 FAME 함량은 논토양에서 진홍미가 193.6 nmol g-1, 신자미가 156.6 nmol g-1으로 밭토양의 진홍미 126.1 nmol g-1, 신자미 107.1 nmol g-1 보다 진홍미는 54%, 신자미는 46% 많았다 (p < 0.001). 이러한 내용은 논토양의 미생물체 함량이 밭토양 보다 높다고 보고한 결과와 일치하였다 (Lee et al., 2011; Chen et al., 2014; Kim et al., 2014). 논토양과 밭토양의 미생물 함량 차이는 그람음성 세균 > 그람양성 세균 > 곰팡이 > 내생균근균 > 방선균 함량 순으로 영향을 준 것으로 나타났다. 품종에 따른 토양 미생물체량은 진홍미가 신자미 보다 많았으며 (p < 0.001) 미생물 함량 차이는 곰팡이 > 그람양성 세균 > 내생균근균 순이었다. 신자미는 안토시아닌이 많은 가공용 고구마로서 (Ahn et al., 2002) 토양에 서식하는 곰팡이 병원균 등에 항균성을 나타내 진홍미에 비해 상대적으로 미생물 함량이 낮아진 것으로 생각된다 (Wen et al., 2016).
Table 4.
Soil microbial properties of different soil types at harvest stage of sweet potato.
|
Soil type
|
Variety
|
FAME† |
TB
|
G(‑)
|
G(+)
|
A
|
F
|
AMF
|
| |
----------------------------------------------- nmol g-1 -----------------------------------------------
|
|
Paddy
|
Jinhongmi
|
193.6
|
57.7
|
28.1
|
25.7
|
4.9
|
26.6
|
13.2
|
|
Sinjami
|
156.6
|
50.8
|
26.0
|
21.6
|
4.0
|
21.1
|
8.4
|
|
Upland
|
Jinhongmi
|
126.1
|
36.6
|
18.4
|
16.6
|
3.2
|
18.1
|
4.3
|
|
Sinjami
|
107.0
|
33.5
|
17.8
|
14.3
|
3.0
|
12.5
|
3.3
|
|
Significance‡ |
Type
|
***
|
***
|
***
|
***
|
**
|
***
|
***
|
|
Variety
|
***
|
*
|
NS
|
**
|
NS
|
**
|
*
|
|
Type×Variety
|
NS
|
NS
|
NS
|
NS
|
NS
|
NS
|
NS
|
†FAME; total ester-linked fatty acid methyl ester; TB, total bacteria; G(‑), Gram negative bacteria; G(+), Gram positive bacteria; A, actinomycetes; F, fungi; AMF, arbuscular mycorrhizal fungi; DHA, dehydrogenase activity.
‡Significant effects were obtained from two-way analysis of variance: NS, not significant; *, significant at
p < 0.05; **, significant at
p < 0.01; ***, significant at
p < 0.001.
토양 미생물 함량을 %로 환산하여 나타낸 미생물 군집은 Table 5와 같다. 내생균근균 군집은 논토양에서 진홍미가 6.8%, 신자미가 5.4%로 밭토양의 진홍미 3.4%, 신자미 3.0% 보다 분포비율이 높았으나 (p < 0.001) 총 세균, 그람음성 세균, 그람양성 세균, 곰팡이, 방선균 군집은 차이가 없었다. 품종에 따른 미생물 군집 변화는 신자미가 총 세균 군집과 그람음성 세균 군집이 진홍미에 비해 많은 비율을 나타냈으나 그람양성 세균, 곰팡이, 내생균근균, 방선균 군집은 차이가 없었다.
Table 5.
Soil microbial communities of different soil types expressed as % total FAME.
|
Soil type
|
Variety
|
TB† |
G(‑)
|
G(+)
|
A
|
F
|
AMF
|
| |
--------------------------------------------------- % ---------------------------------------------------
|
|
Paddy
|
Jinhongmi
|
29.8
|
14.5
|
13.3
|
2.5
|
13.7
|
6.8
|
|
Sinjami
|
32.4
|
16.6
|
13.8
|
2.6
|
13.5
|
5.4
|
|
Upland
|
Jinhongmi
|
29.0
|
14.6
|
13.2
|
2.6
|
14.4
|
3.4
|
|
Sinjami
|
31.3
|
16.6
|
13.4
|
2.8
|
11.7
|
3.0
|
|
Significance‡ |
Type
|
NS
|
NS
|
NS
|
NS
|
NS
|
***
|
|
Variety
|
**
|
*
|
NS
|
NS
|
NS
|
NS
|
|
Type×Variety
|
NS
|
NS
|
NS
|
NS
|
NS
|
NS
|
†TB, total bacteria; G(‑), Gram negative bacteria; G(+), Gram positive bacteria; A, actinomycetes; F, fungi; AMF, arbuscular mycorrhizal fungi.
‡Significant effects were obtained from two-way analysis of variance: NS, not significant; *, significant at
p < 0.05; **, significant at
p < 0.01; ***, significant at
p < 0.001.
토양 유형과 품종에 따른 고구마 수량 및 미생물 군집의 주성분 분석결과는 Fig. 2와 같다. 주성분 분석결과 제1주성분이 38.3%, 제2주성분이 24.1%로서 전체 62.4%의 자료를 설명할 수 있는 것으로 나타났다. 제1주성분은 총 세균 군집과 고구마 수량이 관련된 것으로 나타났으며 제2주성분은 내생균근균 및 방선균이 관련된 것으로 나타났다. 논토양과 밭토양은 제1주성분에서 유의적인 차이가 나타났으나 (p < 0.01) 품종 및 토양 유형과의 상호작용은 유의적인 차이가 없었다.
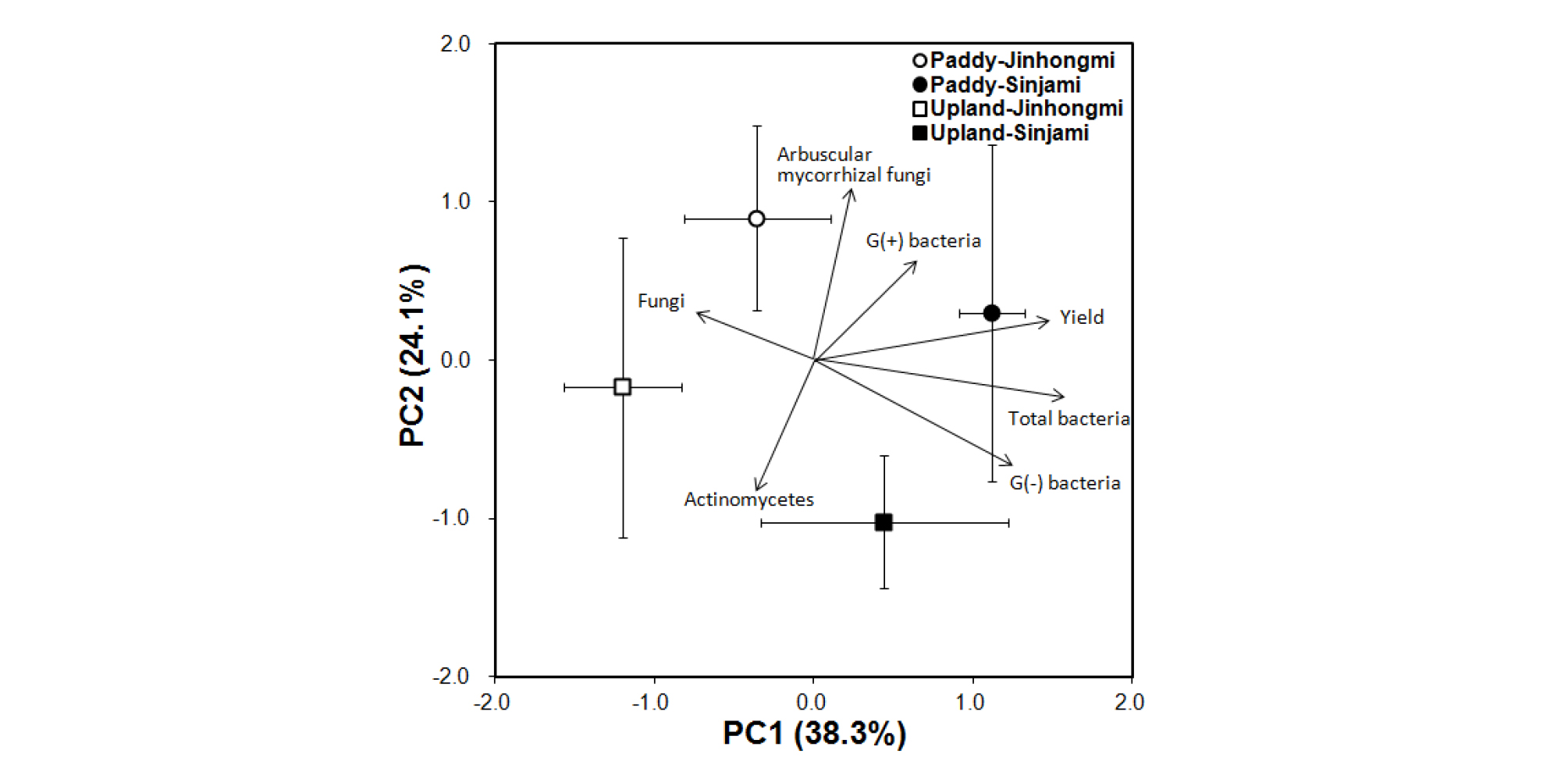
Fig. 2.
Principal component analyses of soil microbial communities of different soil types. The variance explained by each principal component (PC) axis is shown in parentheses. PC analysis shows loading values for the individual microbial biomarkers. The bars represent one standard deviation of the mean. Significant effects of PC1 were obtained from two-way analysis of variance. The soil type was significant at p < 0.01, the variety and their interaction were not significant.
Conclusions
논토양과 밭토양 유형에 따른 고구마 생육과 토양 미생물 군집을 검토하였다. 수확기 밭토양의 pH, 유효인산, 치환성 칼륨, 칼슘 및 마그네슘 함량은 논토양에 비해 높은 수치를 나타냈다. 논토양의 수분함량은 28.5%로서 밭토양에 비해 6.7% 높은 수준을 유지하였으며 이러한 영향으로 고구마 수량은 논토양이 밭토양 보다 진홍미는 34%, 신자미는 24% 증대하여 평균 28% 많았다. 논토양의 미생물 함량은 밭토양에 비해 내생균근균은 2.8배 많았으며 곰팡이, 총 세균, 그람양성 세균, 그람음성 세균 및 방선균은 1.4에서 1.6배 많았다. 논토양의 내생균근균 군집은 진홍미가 6.8%, 신자미가 5.4%로 밭토양의 진홍미 3.4%, 신자미 3.0% 보다 높은 분포비율을 나타냈다. 연구결과를 통하여 논토양은 고구마 생산성과 미생물체량을 증대시키는데 밭토양 보다 효과적인 것으로 판단된다.
Acknowledgements
This work was carried out with the support of “Cooperative Research Program for Agriculture Science & Technology Development (Project No. PJ013824052020)” Rural Development Administration, Republic of Korea.
References
Aderson, W.S. 1941. A preliminary study of some water relations in the sweet potato. Am. Soc. Hortic. Sci. Proc. 39:295-298.
Ahn, Y.S., B.C. Jeong, and Y.B. Oh. 1998. Production and utilization of sweet potato in Korea. In: Proceedings of international workshop on sweet potato production system toward the 21st century, Kyushu National Agricultural Experiment Station, Miyazaki, Japan, pp. 137-147.
Ahn, Y.S., B.C. Jeong, M.N. Chung, J.S. Lee, and Y.H. Oh. 2002. A new purple-flesh and high anthocyanin sweetpotato variety, "Sinjami". Korean J. Breed. 34:379-380.
Ahn, Y.S., B.C. Jeong, M.N. Chung, J.S. Lee, K.B. Jeong, Y.B. Oh, D.H. Jeong, S.Y. Cho, E.S. Kim, and T.G. Kim. 2000. A new sweetpotato (<i>Ipomoea batatas</i> (L.) Lam.) cultivar, "Jinhongmi", for the edible and the starch. Korean J. Breed. 32:95-97.
Attoe, O.J. 1946. Potassium fixation and release in soils occurring under moist and drying conditions. potassium availability. Soil Sci. Soc. Am. J. 11:145-149.
Belehu, T. and P.S. Hammes. 2004. Effect of temperature, soil moisture content and type of cutting on establishment of sweet potato cuttings. S. Afr. J. Plant Soil. 21:85-89.
Bourke, R.M. 1989. Influence of soil moisture extremes on sweet potato yield in the Papua New Guinea highlands. Mt. Res. Dev. 9:322-328.
Chen, X., A. Wang, Y. Li, L. Hu, H. Zheng, X. He, T. Ge, J. Ge, J. Wu, Y. Kuzyakov, and Y. Su. 2014. Fate of 14C-labeled dissolved organic matter in paddy and upland soils in responding to moisture. Sci. Total Environ. 488-489:268-274.
Cho, H.J., Y.H. Lee, S.L. Choi, D.C. Seo, S.R. Min, and J.Y. Heo. 2019. Soil microbial communities of Japanese apricot (<i>Prunus mume</i>) orchard under organic and conventional management. Appl. Biol. Chem. 62:71.
Choi, K.H., N.R. Lee, and S.Y. Lee. 2017. Evaluation of sweet potato cultivars for high yield and optimum processing in Jeonbuk region. Korean J. Crop Sci. 62:367-372.
Choi, K.H., Y.M. Choi, B.S. Heo, S.S. Nam, and S.J. Kwon. 2019. Comparison of growth and yield of sweet potato under paddy cultivation in Jeonbuk Province. p. 36. In Proceedings of the Korean Society of Crop Science Spring Conference 2019, Jinju, Korea.
Clark, C.A. and J.W. Moyer. 1988. Compendium of sweet potato diseases. APS Press, St. Paul, MN, p.74.
Gajanayake, B. and K.R. Reddy. 2016. Sweet potato responses to mid-and late-season soil moisture deficits. Crop Sci. 56:1865-1877.
Ghuman, B.S. and R. Lal. 1983. Growth and plant-water relations of sweet potato as affected by soil moisture regimes. Plant Soil. 70:95-106.
Hamel, C., K. Hanson, F. Selles, A.F. Cruz, R. Lemke, B. McConkey, and R. Zentner. 2006. Seasonal and long-term resource-related variations in soil microbial communities in wheat-based rotations of the Canadian prairie. Soil Biol. Biochem. 38:2104-2116.
Harter, L.L. and W.A. Whitney. 1927. Relation of soil temperature and soil moisture to the infection of sweet potatoes by the stem rot organisms. J. Agri. Res. 34:435-441.
Igalavithana, A.D., S.E. Lee, Y.H. Lee, D.C.W. Tsang, J. Rinklebe, E.E. Kwon, and Y.S. Ok. 2017. Heavy metal immobilization and microbial community abundance by vegetable waste and pine cone biochar of agricultural soils. Chemosphere. 174:593-603.
Jung, B.C., H.K. Shim, and Y.H. Lee. 2001. 10 measures to control Fusarium wilt in sweet potato. Research and Extension. 42:16-19.
Kim, M.K., Y.S. Ok, J.Y. Heo, S.L. Choi, S.D. Lee, H.Y. Shin, J.H. Kim, H.R. Kim, and Y.H. Lee. 2014. Analysis of soil microbial communities formed by different upland fields in Gyeongnam Province. Korean J. Soil Sci. Fert. 47:100-106.
KOSIS (KOrean Statistical Information Service). 2020. http://kosis.kr/statisticsList/ statisticsListIndex.do?menuId= M_01_01&vwcd=MT_ZTITLE&parmTabId=M_01_01#SelectStatsBoxDiv.
Kozai, T., C. Kubota, and Y. Kitaya. 1996. Greenhouse technology for saving the earth in the 21st century. In: Plant production in closed ecosystems. Kluwer Academic Publishers, Dordrecht, the Netherlands, pp. 139-152.
Lee, J.Y., S.G. Hwang, G.S. Yun, I.J. Kim, S.T. Hong, and S.S. Nam. 2019. Growth characteristics of sweet potato varieties under paddy cultivation in Chungbuk Province. p. 43. In Proceedings of the Korean Society of Crop Science Spring Conference 2019, Jinju, Korea.
Lee, Y.H., B.K. Ahn, S.T. Lee, M.A. Shin, E.S. Kim, W.D. Song, and Y.K. Sonn. 2011. Impacts of soil texture on microbial community from paddy soils in Gyeongnam Province. Korean J. Soil Sci. Fert. 44:1176-1180.
Lestari, S.U., A. Hamzah, and R.P.D. Julianto. 2019. Alteration agronomic traits performance of sweet potato cultivars from drylands to paddy fields. J. Degrade. Min. Land Manage. 6:1763-1769.
Liu, Z., X. Chen, Y. Jing, Q. Li, J. Zhang, and Q. Huang. 2014. Effects of biochar amendment on rapeseed and sweet potato yields and water stable aggregate in upland red soil. Catena. 123:45-51.
MAFRA (Ministry of Agriculture, Food and Rural Affairs). 2018. https://www. mafra.go.kr/mafra/1352/subview.do.
Moon, J.Y., B.K. Min, J.H. Shin, Y.C. Choi, and K.P. Hong. 2019. Selection of sweet potato variety for processing under paddy cultivation in Gyeongnam Province. p. 80. In Proceedings of the Korean Society of Crop Science Spring Conference 2019, Jinju, Korea.
Moon, J.Y., B.K. Min, J.H. Shin, Y.C. Choi, H.J. Cho, Y.H. Lee, S.R. Min, and J.Y. Heo. 2019. Growth and yield response of sweet potato to different application rates of chemical fertilizer under polyethylene mulch. Korean J. Soil Sci. Fert. 52:263-270.
Moon, J.Y., B.K. Min, J.H. Shin, Y.C. Choi, H.J. Cho, Y.H. Lee, S.R. Min, and J.Y. Heo. 2019. Influence of foliar fertilization with monopotassium phosphate on growth and yield of sweet potato (<i>Ipomoea batatas</i> L.). Korean J. Soil Sci. Fert. 52:217-225.
Moon, J.Y., J.K. Song, J.H. Shin, Y.C. Cho, J.W. Bae, J.Y. Heo, H.W. Kang, and Y.H. Lee. 2016. Effect of biodegradable mulch film on soil microbial community. Korean J. Soil Sci. Fert. 49:125-131.
Morris, B.E.L., B.R. Crable, and J.M. Suflita. 2008. On the contributions of David Cleaveland White, MD, PhD to microbial ecology: celebrating the life of a pioneer. ISME J. 2:797-804.
Nair, G.M. and V.M. Nair. 1995. Influence of irrigation and fertilizers on the growth attributes of sweet potato. J. Root Crops. 21:17-23.
Nam, S.S., S.Y. Lee, G.D. Yu, H.U. Lee, S. Goh, K.B. Lee, and S.K. Han. 2019. Comparison of sweet potato production under paddy cultivation. p. 39. In Proceedings of the Korean Society of Crop Science Spring Conference 2019, Jinju, Korea.
NIAS (National Institute of Agricultural Sciences). 2010. Methods of soil chemical analysis. Suwon, Korea.
Pardales, J.R. and A. Yamauchi. 2003. Regulation of root development in sweet potato and cassava by soil moisture during their establishment period. Plant Soil. 255:201-208.
Ravi, V. and P. Indira. 1996. Anatomical studies on tuberization in sweet potato under water deficit stress and stress free conditions. J. Root Crops. 22:105-111.
RDA (Rural Development Administration). 2012. Standard of analysis and survey for agricultural experiment. Suwon, Korea.
Ronaghi, M., S. Karamohamed, B. Pettersson, M. Uhlén, and P. Nyrén. 1996. Real-time DNA sequencing using detection of pyrophosphate release. Anal. Biochem. 242:84-89.
SAS Institute. 2019. SAS Version 9.4. SAS Inst., Cary, NC.
Schutter, M.E. and R.P. Dick. 2000. Comparison of fatty acid methyl ester (FAME) methods for characterizing microbial communities. Soil Sci. Soc. Am. J. 64:1659-1668.
Siqinbatu, Y. Kitaya, H. Hirai, R. Endo, and T. Shibuya. 2013. Effects of water contents and CO
2 concentrations in soil on growth of sweet potato. Field Crop. Res. 152:36-43.
Thompson, P.G., D.A. Smittle, and M.R. Hall. 1992. Relationship of sweet potato yield and quality to amount of irrigation. HortScience. 27:23-26.
Wen, H., J. Kang, D. Li, W. Wen, F. Yang, H. Hu, and C. Liu. 2016. Antifungal activities of anthocyanins from purple sweet potato in the presence of food preservatives. Food Sci. Biotechnol. 25:165-171.
Yang, X., A. Tsibart, H. Nam, J. Hur, A. El-Naggar, F.M.G. Tack, C.H. Wang, Y.H. Lee, D.C.W. Tsang, and Y.S. Ok. 2019. Effect of gasification biochar application on soil quality: Trace metal behavior, microbial community, and soil dissolved organic matter. J. Hazard. Mater. 365:684-694.
Yi, Y.S., D.Y. Choi, H.J. Cho, J.Y. Heo, and Y.H. Lee. 2020. Effect of wood-derived biochar application on the soil microbial community in upland field. Korean J. Soil Sci. Fert. 53:50-58.